微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列液体混合物用分液漏斗可以分离的是? [???? ]
A.溴苯和水
B.甘油和水
C.氢氧化钠和乙醇
D.苯和乙醇
参考答案:A
本题解析:
本题难度:简单
2、选择题 下面给出四种不同溶质在X、Y两种溶剂中的溶解度数据,X、Y两种溶剂互不相溶。若要用X萃取Y中的四种溶质,下列各组中,萃取效果最好的是[???? ]
在X中的溶解度/g
在Y中的溶解度/g
A.
20
?5
B.
20
0.1
C.
5
1
D.
10
12
参考答案:B
本题解析:
本题难度:简单
3、选择题 某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好 是加入下列物质中的?
?? [???? ]
A.食盐、硫酸
B.胆矾、石灰水
C.铁粉、生石灰
D.苏打、盐酸
参考答案:C
本题解析:
本题难度:一般
4、填空题 海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示:
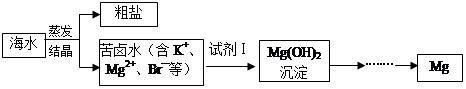
(1)工业制取镁的方法是???????????????????????法。
(2)试剂Ⅰ一般选用????????????(填化学式)。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
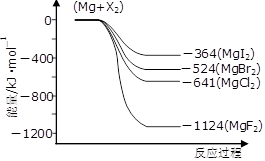
①由图可知Mg与卤素单质的反应均为????????????(填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2???????MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式??????????????????????。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式???????????????????。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因????????。
参考答案:(1)电解法或电解熔融氯化镁
(2)Ca(OH)2(该
本题解析:
试题分析:(1)镁是活泼的金属,工业制取镁的方法是电解熔融的氧化镁,即电解法冶炼镁。
(2)要将溶液中的Mg2+转化为氢氧化镁沉淀,需要加入碱。考虑试剂的来源和经济效益,一般加入的是氢氧化钙,化学式为Ca(OH)2。
(3)①由图可知反应物的总能量均高于生成物的总能量,所以Mg与卤素单质的反应均为放热反应。镁与单质氟反应放出的热量最多,则生成的MgF2稳定性最强,所以化合物的热稳定性顺序为MgI2<MgF2。
②根据图像可知,Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ/mol、Mg(s)+Br2(l)=MgBr2(s) △H=-524kJ/mol,则根据盖斯定律可知,前者减去后者即得到反应MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l),所以该反应的反应热△H=-641kJ/mol+524kJ/mol=-117KJ/mol。
(4)CH3MgCl易与水发生水解反应并有无色无味气体生成,则该气体应该是甲烷。所以根据原子守恒可知,另外的生成物是碱式氯化镁,因此CH3MgCl水解的化学方程式为CH3MgCl+H2O=CH4↑+Mg(OH)Cl↓或2CH3MgCl+2H2O=2CH4↑+Mg(OH)2↓+MgCl2。
(5)氢氧化镁溶于水存在溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH?(aq),铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。
Mg2+(aq)+2OH?(aq),铵根离子结合氢氧根离子生成一水合氨,降低了氢氧根离子浓度,使氢氧化镁沉淀的溶解平衡向右移动,沉淀溶解。
本题难度:一般
5、填空题 下表是四种盐在不同温度下的溶解度(g/100g水):
?
| NaNO3
| KNO3
| NaCl
| KCl
|
10℃
| 80.5
| 21.2
| 35.7
| 31.0
|
100℃
| 175
| 246
| 39.1
| 56.6
?
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:

(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水???????? b.冰水??????? c.95%的酒精??????? d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
参考答案:(1)温度;? C (1分)
(2)加水溶解、蒸发浓缩
本题解析:
试题分析:(1)往水中加入等量的NaNO3、KCl,溶液中有等量的Na+、NO3—、K+、Cl—,任意两两组合可得到表中的4中盐类,根据表中数据,表中四种盐类在水中的溶解度随着温度的升高而升高,尤其是KNO3 随温度升高溶解度急剧增大,因此要从溶液中分离出KNO3 应该控制温度来实现分离,因为实验目的是得到硝酸钾晶体,因此晶体C才是目标产物。
(2)要得到硝酸钾晶体,应该利用NaCl随温度变化溶解度变化不大,而KNO3 随温度升高溶解度急剧增大的特点,在实验步骤1中先把固体溶解,然后蒸发浓缩,此时NaCl随温度变化溶解度变化不大以晶体形式析出,所以趁热过滤,分离后KNO3 留在了滤液B中,然后再对滤液B蒸发浓缩冷却结晶,KNO3 溶解度急剧减小析出晶体,再过滤可得KNO3 晶体。
(3)由于改变温度必然有少量杂质NaCl也会混在粗产品KNO3 晶体中,因此含有Na+、Cl?杂质离子,检验的方法是用焰色反应检验钠离子,用硝酸银试剂检验氯离子。
(4)洗涤产品原则是能够起到洗涤杂质离子的作用同时尽量减少产品的损失,所以应尽可能用温度低的洗涤剂或者产品难溶但杂质可溶的洗涤剂,所以综合考虑应选bc。
(5)根据100℃蒸发后的溶液中NaCl为饱和溶液,KNO3为不饱和溶液,所以根据溶解度定义
100℃蒸发掉50.0克H2O后溶液中NaCl的质量为 ,又初始加入的物质为 ,又初始加入的物质为 ,所以相当于n(NaCl)=0.4mol,即m总(NaCl)=0.4mol×58.5g/mol=23.4g,所以析出的NaCl有23.4g-7.82g=15.6g。 ,所以相当于n(NaCl)=0.4mol,即m总(NaCl)=0.4mol×58.5g/mol=23.4g,所以析出的NaCl有23.4g-7.82g=15.6g。
本题难度:一般
|