微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等体积等浓度的MOH强碱溶液和HA弱酸溶液混和,溶液中离子浓度关系不正确的是
A.c(M+)=c(HA)+c(A-) B.c(M+)>c(H+)>c(A-)>c(OH-)
C.c(OH-)=c(H+)+ c(HA) D.c(M+)+c(H+) =c(OH-)+c(A-)
参考答案:B
本题解析:
试题分析:等体积等浓度的MOH强碱溶液和HA弱酸溶液混和,生成强碱弱酸盐MA,由于强碱弱酸盐MA中弱酸根的水解,溶液呈碱性;A、由元素守恒得c(M+)=c(HA)+c(A-),A正确;B、离子浓度大小关系为c(M+)> c(A-)> c(H+)>c(OH-),B错误;C、由质子守恒得c(OH-)=c(H+)+ c(HA),C正确;D、由电荷守恒得c(M+)+c(H+) =c(OH-)+c(A-),D正确;答案选B。
考点:盐的水解
本题难度:一般
2、选择题 在10 mL 0.1 mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,反应后溶液中各粒子的浓度关系错误的是
A.C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
B.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
C.C(Na+)= C(CH3COO-)+C(CH3COOH)
D.C(Na+)+ C(H+)= C(CH3COO-)+C(OH-)
参考答案:A
本题解析:
试题分析:10 mL 0.1 mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,酸碱恰好反应生成CH3COONa ,CH3COONa属于强碱弱酸盐,CH3COO-会水解导致溶液显碱性,CH3COO-浓度减小,所以反应后溶液中各粒子的浓度关系为C(Na+)>C(CH3COO-)>C(OH-)>C(H+),A项错误;B项正确;C项符合物料守恒,正确;D项符合电荷守恒,正确;选A。
考点:考查溶液中离子浓度的大小比较。
本题难度:一般
3、选择题 下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生现象剧烈的反应
B.Al、Al2O3、Al(OH)3、NaAlO2均能和NaOH溶液发生反应
C.NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
参考答案:C
本题解析:
试题分析:A、铁在常温下,与浓硝酸、浓硫酸发生钝化,故A错误;B、NaAlO2不能和NaOH溶液发生反应,故B错误;C、NaHCO3可用于制备纯碱、治疗胃酸过多的药剂、食品发酵剂,故C正确;D、FeCl3、CuCl2能发生水解反应,生成易挥发的HCl,使水解平衡不断向右移动,所以制备FeCl3、CuCl2固体不能采用将溶液直接蒸干的方法,故D错误。
考点:本题考查物质的性质与用途、盐类的水解。
本题难度:一般
4、填空题 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
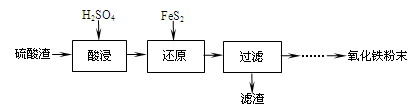
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K 2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
| Mn(OH)2
|
开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
| 8.3
|
完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
| 9.8
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤; d. 烘干,研磨。
参考答案:(1)抑制Fe3+的水解 (1分)
(2)1
本题解析:
试题分析:试题分析:(1) 酸浸”中硫酸要适当过量,抑制Fe3+的水解;
(2)由信息Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,在利用氧化还原反应配平方程式:14Fe3++FeS2+8H2O ===15Fe2++2SO42—+16H+;
(3)①若SnCl2不足量,Fe3+没有完全还原为Fe2+,则测定的Fe3+量偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。
(4)①检验滤液中含有Fe3+是KSCN溶液;Fe2+的氧化反应是:4Fe2++O2+4H+ ===4Fe3++H2O;
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌;b.滴加NaOH溶液,调节溶液的pH为3.2~3.8,使Fe3++完全沉淀。
考点:化学与STS问题。
本题难度:一般
5、选择题 在25ºC时,某氯化铵溶液的pH=4,下列说法中不正确的是:
A.溶液中c(H+)>c(OH-),且Kw=c(H+).c(OH-)=1×10-14mol2/L2
B.由水电离出来的H+浓度为1×10-4mol/L-1
C.溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.此溶液中由水电离出来的c(H+)=c(OH-)
参考答案:A
本题解析:A、该溶液水解呈酸性,
B、盐类水解促进水的电离,正确;
C、铵根水解生成氢离子和一水合氨;正确
D、任何溶液中水电离的氢离子等于氢氧根离子。正确
本题难度:简单
|