微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 根据下列装置图,回答有关问题:
 ?
?
(1)写出装置图中标号仪器的名称:①?????????;②???????????。
(2)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:?????????,并据此选择上图中?????????(填字母)组装一套制取干燥二氧化碳的装置。收集二氧化碳时,验满的方法是??????????。
(3)如选用装置A作为制取氧气的发生装置,其化学方程式为??????????。
参考答案:(8分)试管 ; 玻璃导管?;CaCO3+2HCl==CaC
本题解析:
试题分析:(1)直接写出图中所给装置的名称,故本题答案为:铁架台; 集气瓶。
(2)用大理石和稀盐酸制取二氧化碳的反应装置和反应原理:使用固体+液体反应,不需加热,所以可在C装置中制取二氧化碳,根据二氧化碳的密度比空气大,能够溶于水,故可以用D装置来收集二氧化碳,二氧化碳不能燃烧也不支持燃烧,所以可用燃着的木条来验满。(3)根据用高锰酸钾制取氧气的反应装置和反应原理来选择发生装置:加热固体,故用B装置制取,故本题答案为:B; 2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
点评:熟练掌握两套制取气体的发生装置,并能够根据反应条件和原理来选择发生装置,并会根据物质的物理性质来选择合适的收集、验满等方法及装置,并且熟记化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑,2KMnO4 K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
本题难度:一般
2、选择题 关于下列装置用途的判断正确的是??????????????????????????????????????????????????????????????(???)

①装置甲可防止铁钉生锈???????????????????????????????②装置乙可除去乙烯中混有的SO2
③装置丙可检验NH3在水中的溶解性???④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、CHl、NO2等气体
A.只有③④
B.只有③⑤
C.只有①③⑤
D.只有①②④
参考答案:B
本题解析:略
本题难度:一般
3、实验题 某研究小组探究SO2和Fe(NO3)3溶液的反应。
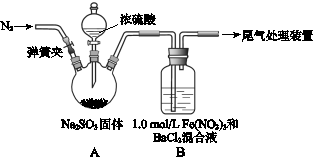
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是????????。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是????????。
(3)装置B中产生了白色沉淀,其成分是????????,说明SO2具有????????性。
(4)分析B中产生白色沉淀的原因:
观点1:????????_____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是????????。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号)????????。
a.0.1 mol·L-1稀硝酸?????????????????????
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
参考答案:(12分)
(1)Na2SO3+H2SO4(浓)=Na
本题解析:
试题分析:(1)装置A中的反应是制取SO2,方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)反应前要充入N2,排除装置A中的空气,反应对实验的干扰。
(3)硝酸具有氧化性,白色沉淀为BaSO4,说明SO2具有还原性。
(4)经过分析,各个观点,得出观点1是SO2和Fe3+、酸性条件下NO3-都反应。
①Fe3+把SO2氧化,离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+。
②Fe(NO3)3中有Fe3+,a错;NO3-在酸性条件下有氧化性,b错。故选c。2制备 Fe3+、NO3-的氧化性
点评:本题考查的是SO2制备和Fe3+、NO3-的氧化性的相关知识,题目难度较大,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。
本题难度:一般
4、实验题 (16分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
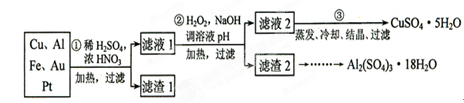
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是????????????
?????????????????????????;调溶液pH的目的是使??????????生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是????????????????????。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
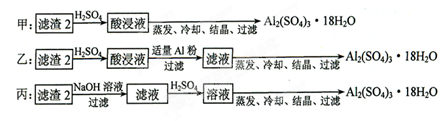
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用cmol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶???
b.滴定终点时滴定管尖嘴中产生气泡???
c.未除净可与EDTA反应的干扰离子
参考答案:(1)Cu+4H++2NO3- 本题解析:(1)稀硫酸和铜不反应,所以硝酸才能溶解铜,方程式为Cu+4H++2NO3-
本题解析:(1)稀硫酸和铜不反应,所以硝酸才能溶解铜,方程式为Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;由于浓硝酸也不能溶解金和Pt,所以滤渣1的主要成分为Au和Pt。
3Cu2++2NO↑+4H2O;由于浓硝酸也不能溶解金和Pt,所以滤渣1的主要成分为Au和Pt。
(2)由于滤液中I中含有亚铁离子,必须除去,而双氧水能氧化亚铁离子生成铁离子,然后沉淀生成氢氧化铁而除去;双氧水的还原产物是水,不引入杂质,对环境无污染;可知pH的目的是除去溶液中的铁离子和铝离子,以得到纯净的硫酸铜晶体。
(3)胆矾通过加热脱水即生成硫酸铜。
(4)由于滤渣Ⅱ中含有氢氧化铁,所以甲方案中会产生硫酸铁,即最终所得产品中含有较多Fe2(SO4)3杂质,所以甲方案是不正确的;丙方案中有硫酸钠生成,所以原子利用率不如乙方案。
(5)根据方程式可知,20ml溶液中铜离子的物质的量是0.001bcmol,所以CuSO4·5H2O质量分数的表达式w=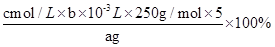 ;锥形瓶不需要干燥,a不影响;滴定终点时滴定管尖嘴中产生气泡,说明消耗的标准液体积偏小,则测定结果偏低;未除净可与EDTA反应的干扰离子,则消耗的标准液体积偏大,测定结果偏高,答案选c。
;锥形瓶不需要干燥,a不影响;滴定终点时滴定管尖嘴中产生气泡,说明消耗的标准液体积偏小,则测定结果偏低;未除净可与EDTA反应的干扰离子,则消耗的标准液体积偏大,测定结果偏高,答案选c。
本题难度:一般
5、选择题 某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2,极易与H2O反应)
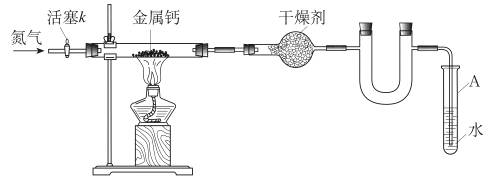

下列说法正确的是
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸
C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
D.将产物Ca3N2放入盐酸中,只能得到一种盐
参考答案:C
本题解析:略
本题难度:一般