微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl23.O mol·L-1、FeCl3 1.0 mol·L-1、HCl3.0 mol·L-1。取废腐蚀液200mL按如下流程在实验室进行实验:
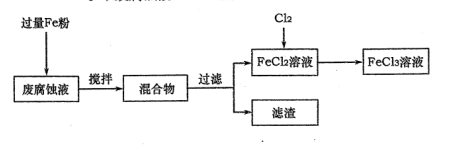
回答下列问题:
废腐蚀液中加入过量铁粉后,发生反应的离子方程式为???????????????????。
②检验废腐蚀液中含有Fe3+的实验操作是?????????????????????????????;
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、?????。
③由滤渣得到纯铜,除杂所需试剂是????????。
(2)某化学兴趣小组利用下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
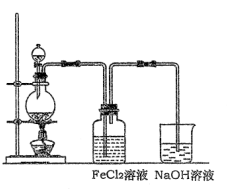
①实验开始前,某同学对实验装置进行了气密性检查,方法是??????????????????。
②浓盐酸与二氧化锰反应的化学方程式为????????????????????????????????????;
烧杯中NaOH溶液的作用是????????????????????????????????。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于???????g,
需通入Cl2的物质的量应不少于?????mol.
参考答案:(1)①2Fe3++Fe=3Fe2+???? Cu2++Fe
本题解析:(1)①铁粉可与Fe3+、Cu2+、H+发生反应,最终得到FeCl2溶液
②Fe3+的检验,一般用KSCN溶液,观察是否有血红色出现;过滤需要的玻璃仪器包括:漏斗、烧杯、玻璃棒
③滤渣中含有的包括过量的铁粉以及置换出的铜,故可用盐酸溶解铁粉,过滤即可得到铜
(2)①考查实验基本操作:气密性的检验
②考查氯气的实验原理及尾气吸收
③由所涉及反应可知,Fe3+、Cu2+、H+共可消耗0.7mol铁粉,即39.2g;得到的FeCl2溶液中溶质的物质的量为1.5mol,由2FeCl2+Cl2=2FeCl3可得到所需氯气的物质的量为0.75mol
本题难度:一般
2、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4C1、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
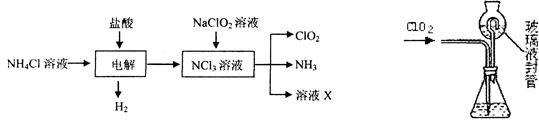
⑴ 写出电解时发生反应的化学方式:????????????????????????????????????。
⑵ 测定ClO2(如右图)的过程如下:在锥形瓶中加入足最的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
① ClO2通入锥形瓶与酸性碘化钾溶液反应,反应的离子方程式为:???????????????????。
② 装置中玻璃液封管的作用是???????????????????、???????????????????。
③ 滴定至终点的现象是??????????????????????????????????。
④ 测得ClO2的质量m(ClO2)=??????????。(用含c、V的代数式表示)
参考答案:⑴ NH4Cl+2HCl=3H2↑+NCl3(1分)
本题解析:
试题分析:(1)电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气、和NCl3,其电解反应方程式为:NH4Cl+2HCl 3H2↑+NCl3.
3H2↑+NCl3.
(2)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③淀粉溶液作指示剂,结合反应I2+2S2O32-=2I-+S4O62-可以判断溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点。
④VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2????????????????10
n(ClO2)?????c?V?10-3 mol
所以n(ClO2)=1/5c?V?10-3 mol.
所以m(ClO2)=1/5c?V?10-3 mol×67.5g/mol=1.35cv×10-2g.
本题难度:困难
3、计算题 过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
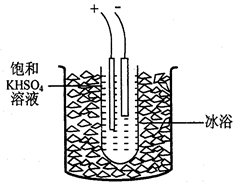
步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为??????????????????????????????????????????。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是???????????????????????????。
(4)步骤5回收乙醇、乙醚时采用的操作方法是??????????????????????????????。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是???????????????????????????。
②本实验所用的指示剂为????????????????????????????。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
参考答案:
(1)2KHSO4 本题解析:
本题解析:
试题分析:(1)电解KHSO4溶液,SO42-失电子生成S2O82-,H+得电子生成H2。(2)阳极为阴离子放电,生成能氧化I-的气体,且为有色,则应为O3,可理解成OH-放电生成O2,O2在放电条件下进一步转化为O3。(3)由信息知,过二硫酸钾易分解,故需要在低温下生成。(4)乙醇和乙醚为相互溶解的有机物,可利用两者沸点不同而蒸馏分开。(5)I-易被氧化,如空气中的O2,故实验中需要封密。淀粉与I2显蓝色,该实验中当I2被消耗时,蓝色会褪去,从指示反应的终点。由方程式找出关系式:
K2S2O8~I3- ~I2~2S2O32-
270???????????? 2
m(K2S2O8)???????? cV10-3
w(K2S2O8)= m(K2S2O8)/0.25 =54cv%。
(6)Mn由+2价升到+7价,S由+7降到+6,根据得失电子守恒配平反应,再由电荷守恒确定出产物中有H+,最后由H原子守恒,确定反应物中还有H2O,并配平。
本题难度:一般
4、实验题 在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应制取乙醛。装置图如下:(夹持装置均已略去)
供选用试剂:电石(混有CaS等杂质)、HgO粉末、浓H2SO4、NaOH溶液、蒸馏水
资料提示:CaS遇水会产生H2S气体;HgSO4遇到H2S会发生催化剂中毒而失去活性。
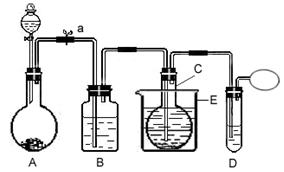
回答下列问题:
(1)加入药品前,必须对装置进行的操作是:?????????????????????????????????。
(2)装置B中盛放的试剂为???????? ?,作用是?? ???????????
(3)写出A中发生的主要反应的化学方程式???????????????????????????????????
(4)反应温度应控制在75℃左右,采用E装置的优点是?????????????????????????
参考答案:
 本题解析:略
本题解析:略
本题难度:简单
5、实验题 下列装置为中学化学实验常用的气体制备装置
 ???????
??????? ??????
??????
A???????????? B????????? C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 ???????????。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 ????????????????。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置???????????。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置?????????。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 ?????????????????????????????????????????????????????????????。
写出氯气和氯化亚铁溶液反应的离子方程式:???????????????????????????????????。
③请写出氯气尾气处理的离子方程式 ????????????????????????????????????????????。
参考答案:(1)A(2)C(3)A (4)① A ②取洗气瓶中C中的溶
本题解析:
试题分析:(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置是固体和固体需要加热的,因此符合条件的是选项C。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(4)①根据反应的方程式可知Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2+2H2O,该反应是固体和液体之间不需要加热制备气体的,所以应该选择装置A。
②由于亚硫酸钡不溶于水,但能溶于水酸中。而硫酸钡不溶于水,也不溶于酸,所以证明亚硫酸钠已经被氧化实验方法是取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;氯气和氯化亚铁溶液反应的离子方程式是Fe2++ Cl2=2 Fe3++2 Cl-。
③氯气有毒,需要尾气处理,一般用氢氧化钠溶液吸收,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+ 2H2O。
点评:本题主要是考查学生对于装置的选取方法的应用及方程式的书写等知识,可以很好的考查学生对于知识的理解和应用能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的应试能力和学习效率。
本题难度:一般