微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 海带中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:(已知:Cl2 + 2KI =" 2KCl" + I2)
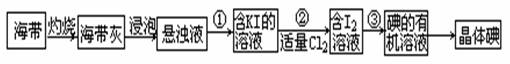
(1)提取碘的流程中:步骤①需要的主要仪器是??????????,步骤③需要的主要仪器是??????????(填序号)
 ?
?
(2)写出步骤②中涉及的有关离子反应方程式???????????????????????????。
(3)提取碘的过程中,可供选择的有机试剂有??????????。
A.四氯化碳
B.醋酸
C.酒精
D.苯
2、选择题 除去CO中少量的CO2,选用的试剂和装置均正确的是( )
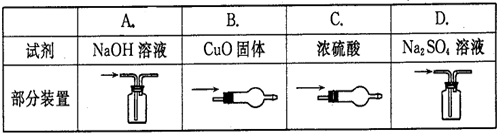
A.A
B.B
C.C
D.D
3、填空题 (2014届上海市十三校高三测试化学试卷)
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
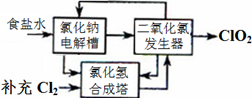
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
4、简答题 如图均为实验室收集气体的装置.
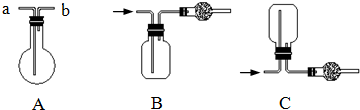
请回答:
(1)可用装置B收集的气体是______(填序号),可用装置C收集的气体是______(填序号).
①Cl2②NH3
(2)若用装置A收集CH4,则气体应从______(填“a”或“b”)口进入烧瓶.
(3)在如图收集NH3的装置中,干燥管中的试剂是______.
5、实验题 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂。反应原理为:
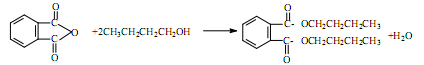
实验步骤如下:
步骤1:在三颈瓶中放入14.8g邻苯二甲酸酐、25mL正丁醇、4滴浓硫酸,开动搅拌器b(反应装置如图)。
步骤2:缓缓加热至邻苯二甲酸酐固体消失,升温至沸腾。
步骤3:等酯化到一定程度时,升温至150℃
步骤4:冷却,将三颈瓶中的液体倒入分漏斗中,用饱和食盐水和5%碳酸钠洗涤。
步骤5:减压蒸馏,收集200~210℃2666Pa馏分,即得DBP产品
(1)浓硫酸的作用??????????????????????,搅拌器的作用??????????????????????。
(2)反应过程中正丁醇过量的目的是???????????????????????????????????????????。
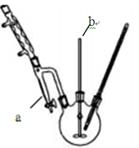
(3)图中仪器a的名称是分水器,试分析它的作用是?????????????????????????????。
步骤3中确定有大量酯生成的依据是???????????????????????????????????????。
(4)碳酸钠溶液洗涤的目的是?????????????????????????????????????????????????。
用减压蒸馏的目的是?????????????????????????????????????????????????????。
(5)写出正丁醇在135℃生成醚的反应方程式???????????????????????????????????。
写出DBP在氢氧化钠溶液中水解的方程式???????????????????????????????。