微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯气和氮氧化物都是重要的化工原料,但进入大气后,都对环境造成污染。
【Ⅰ】已知:2KMnO4+16HCl(浓)= 2KCl+2MnCl2+5Cl2↑+ 8 H2O,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
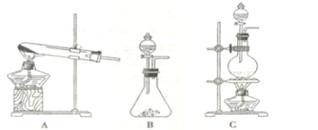
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是??????。(选填A或B或C)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式:???????????????????。
(3)常用NaOH溶液吸收氯气防止污染。写出该反应的离子方程式????????????????。
【Ⅱ】已知:NO2+NO+2NaOH=2NaNO2+H2O,可用氢氧化钠溶液可以吸收废气中的氮氧化物。
(1)在该反应中,氧化剂是????????。???
(2)汽车尾气中含有一氧化氮和一氧化碳,经过排气管中的催化转化器转化为对大气无污染的物质。写出该反应的化学方程式:?????????????????????????????????。
参考答案:【Ⅰ】(1)B?(2) 4HCl(浓)+MnO2![]()
本题解析:
试题分析:【Ⅰ】(1)用高锰酸钾固体和浓盐酸反应制取氯气,依据题给反应的特征是固体和液体不加热制气体,选择发生装置B;(2)二氧化锰与浓盐酸在加热条件下反应生成二氯化锰、氯气与水,反应方程式为:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
MnCl2+Cl2↑+2H2O(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
【Ⅱ】(1)反应NO2+NO+2NaOH═2NaNO2+H2O中,NO2中N元素化合价由+4价降低为NaNO2中的+3价,NO2是氧化剂;(2)一氧化氮和一氧化碳经过排气管中的催化转化器转化为对大气无污染的物质,应生成氮气、二氧化碳,反应方程式为:2NO+2CO N2+2CO2。
N2+2CO2。
本题难度:一般
2、实验题 下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白:
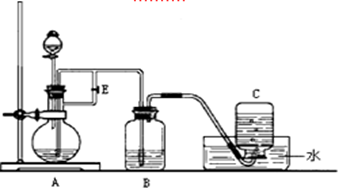
(1)B中盛有一定量的??????????????,A中应预先加入的试剂是?????????,A中反应的化学方程式为????????????????????????????????????????。
(2)实验开始时应先将活塞E???????(填“打开”或“关闭”),目的是??????????????????????????????????。
(3)A反应一段时间后将活塞E???????(填“打开”或“关闭”),目的是???????
????????????????????????????????????。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为?????????L(标准状况)。
参考答案:(1)NaOH溶液?铁屑?? Fe+H2SO4===FeSO
本题解析:制取Fe(OH)2的关键是防止氧气的氧化,预先排除装置中的空气,结合所给装置及药品,制取Fe(OH)2:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;而通过反应Fe+H2SO4=FeSO4=H2↑产生的氢气来排除装置中的空气;
(1)检验装置气密性后,在A烧瓶中放入铁屑,分液漏斗中装有稀硫酸,B中盛放NaOH溶液
(2)实验开始时应先将活塞E打开,打开分液漏斗的活塞,产生氢气,让生成的氢气排走装置和溶液中的空气
(3)A反应一段时间后将活塞E关闭,继续产生的氢气使烧瓶内压强增大,把A中FeSO4溶液压入B中反应,与其中的NaOH溶液反应生成白色Fe(OH)2沉淀;
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化,沉淀颜色由白迅速置换为灰绿色,最终转变为红褐色,完成实验
由4Fe(OH)2+O2+2H2O=4Fe(OH)3可知,反应中有4个电子的转移,当反应过程中转移了0.04mol电子,则参加反应的氧气为0.01mol,标准状况下体积为0.224L
本题难度:简单
3、选择题 下列气体中,不能用排水法收集的是
A.NO2
B.NO
C.O2
D.H2
参考答案:A
本题解析:
试题分析:根据气体的溶解性、是否和氧气反应及气体的密度来确定气体的收集方法,溶于水且与水反应的气体不能用排水法收集,和氧气反应的气体不能用排空气法收集。A、NO2易溶于水且与水反应,不能用排水法收集,正确;B、NO难溶于水且和水不反应,可以用排水法收集,错误;C、氧气难溶于水且和水不反应,可以用排水法收集,错误; D、氢气难溶于水且和水不反应,可以用排水法收集,错误。
本题难度:一般
4、实验题 (17分)甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸。请你为他配制100 mL 3.0 mol·L-1稀硫酸。
(1)建议配制过程如下:
①计算所需浓硫酸的体积是????????(准确到小数点后一位),量取浓硫酸所用的量筒的规格是???(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
②稀释。具体操作过程是??????????????????????????????????????????。
③待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入?????????。用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。
④将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用?????加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。
⑤将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中????????????
B.容量瓶用蒸馏水洗涤后残留有少量的水????????????
C.所用过的烧杯、玻璃棒未洗涤?????????????
D.定容时俯视刻度线?????????????
参考答案:16.3mL? B或25mL(1分,其它每空2分)??沿装有
本题解析:
试题分析:(1)1、设浓硫酸的体积为V,18.4mol/L×V=0.1L×3.0mol/L,V=0.0163L=16.3mL;选取量筒的容积应稍大于或等于量取溶液的体积,故选B。
故答案为:16.3ml;B;
然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌,防止液体飞溅,
故答案为:沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌;
3、洗涤液要转移到100mL容量瓶中,故答案为:100mL容量瓶;
4、将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用 胶头滴管加水至液面与刻度线相切.盖好瓶塞,反复上下颠倒、摇匀。
故答案为:胶头滴管;
(2)A.所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸有吸水性,导致溶质的物质的量偏小,配制溶液的浓度偏低;
B.容量瓶用蒸馏洗涤后残留有少量的水,不影响溶质的物质的量和溶液的体积,所以配制溶液的物质的量浓度无影响。
C.所用过的烧杯、玻璃棒未洗涤,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D.定容时俯视溶液的液凹面,导致溶液的体积偏小,所以配制溶液的浓度偏高。
故答案为:偏低;无影响;偏低;偏高.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据量取浓硫酸的体积选择量筒
本题难度:一般
5、实验题 (10 分)结合下列实验装置图回答问题:
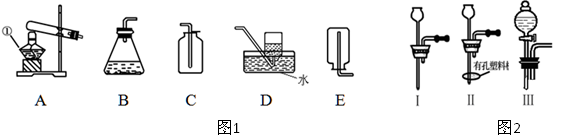
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是??,收集装置是??。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 ?Na2CO3 + H2O +CO2↑
?Na2CO3 + H2O +CO2↑
NH4HCO3 ?NH3 ↑+ H2O +CO2↑
?NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是??????????。
他不选用碳酸氢铵制取CO2的理由是???????????????????????????????????。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
参考答案:(1)①B(2分) C(2分)②A(2分)碳酸氢铵加热分解会
本题解析:(1)①大理石与盐酸反应,不需要加热,所以选择B装置。CO2能溶于水,但密度大于空气的,所以应该用向上排气法收集,答案选C。
②由于碳酸氢钠分解需要加热,且碳酸氢钠是固体,所以应该选择装置A;由于碳酸氢铵加热分解会产生CO2和NH3的混合气体,从而制得的CO2不纯,所以不选用碳酸氢铵制取CO2。
(2)要想控制反应速率,则必须选择分液漏斗,即选择装置Ⅲ。
本题难度:一般