微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中必须加入还原剂才能进行的是
A.Zn→Zn2+
B.H2→H2O
C.CaO→Ca(OH)2
D.CuO→Cu
参考答案:D
本题解析:
试题分析:应用还原剂失去电子,化合价升高,所以反应中必须加入还原剂才能进行,这说明选项中的微粒应该是得到电子,化合价降低作氧化剂,据此可知A、锌的化合价升高,需要加入氧化剂;B、氢元素的化合价升高,需要加入氧化剂;C、元素的化合价均不变,所以不需要氧化剂;D、铜元素的化合价降低,需要加入还原剂,答案选D。
考点:考查氧化还原反应的应用
本题难度:一般
2、填空题 溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 条件下进行,目的是为了避免 。
(2)Br2可用热空气吹出,其原因是 。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为 .
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
参考答案:
(1)酸性,Cl2歧化。
(2) Br2易挥发
本题解析: Cl2与水发生歧化反应:Cl2+H2O=HCl+HClO,在酸性条件下可抑制该反应。步骤③所发生反应是归中反应,盐酸有还原性,NaBrO3有氧化性,二者可发生氧化还原反应;因为Br2有强氧化性,为了防止在运输过程中Br2与其它物质反应,因此步骤②的产品有时运输到目的地后再酸化。利用Br-与Cl2反应,可除去Cl2。
【考点定位】本题考查工业制Br2,考查分析问题解决问题的能力。
本题难度:一般
3、选择题 需加入适当的氧化剂才能实现的反应是( )
A PCl5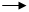 PCl3 B. MnO2
PCl3 B. MnO2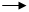 Mn2+
Mn2+
C.SO2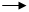 SO32- D. Fe
SO32- D. Fe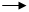 Fe3O4
Fe3O4
参考答案:D
本题解析:氧化剂具有氧化性,发生还原反应,化合价降低;还原剂具有还原性,发生氧化反应,化合价升高。故加入氧化剂后,应有元素化合价升高。据此答题。
A、磷元素化合价降低,发生还原反应,应加入还原剂。
B、锰元素化合价降低,发生还原反应,应加入还原剂。
C、各元素化合价没有发生变化,没有发生氧化还原反应,不需加入氧化剂、还原剂。
D、铁元素化合价升高,发生氧化反应,加入的是氧化剂。
故选D
本题难度:一般
4、选择题 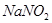 是一种食品添加剂,它与酸性
是一种食品添加剂,它与酸性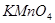 溶液可发生反应
溶液可发生反应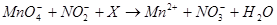 (未酸平)。下列叙述中正确的是
(未酸平)。下列叙述中正确的是
A.生成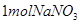 需消耗
需消耗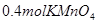
B.反应过程中溶液的pH减小
C.该反应中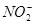 被还原
被还原
D.X可以是盐酸
参考答案:A
本题解析:
试题分析:A、Mn元素的化合价从+7降到+2价,得到5个电子,N元素的化合价从+3升高到+5价,生成1mol的硝酸钠则失去2mol电子,根据得失电子守恒,需要KMnO4的物质的量是2mol/5=0.4mol,正确;B、根据元素守恒可知x为氢离子,反应后氢离子浓度降低,溶液pH增大,错误;C、该反应中NO2一中的N元素的化合价升高,被氧化,错误;D、X不能是HCl,因为高锰酸钾会氧化氯离子为氯气,错误,答案选A。
考点:考查氧化还原反应的分析
本题难度:一般
5、选择题 下列物质与水反应过程中,水得到电子的是( )
A.二氧化氮
B.氯气
C.钠
D.氨气
参考答案:C
本题解析:
试题分析:A、3NO2+H2O=2HNO3+NO,水中无元素化合价变化。B、Cl2+H2O=HCl+HClO,水中无元素化合价变化。C、2Na+2H2O=2NaOH+H2↑水中氢元素得电子,C正确;D、NH3+H2O=NH3·H2O,非氧化还原反应。选C。
考点:水的化学性质 氧化还原反应
本题难度:一般