微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 锌和稀盐酸常温下反应,铜和浓硫酸加热条件下反应,影响化学反应速率的根本因素是( )
A.温度
B.溶液的浓度
C.温度和溶液的浓度
D.参加反应的各物质的性质
参考答案:影响化学反应速率的因素有物质本身的性质及外界条件,温度、浓度
本题解析:
本题难度:简单
2、选择题 已知某反应的各物质浓度数据如下:
aA(g)+bB(g)  2C(g)
2C(g)
起始浓度(mol·L-1)???? 3.0????? 1.0???????? 0
2 s末浓度(mol·L-1)??? 1.8????? 0.6?????? 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是
( )。
A.9∶3∶4
B.3∶1∶2
C.2∶1∶3
D.3∶2∶1
参考答案:B
本题解析:各物质的反应速率之比等于它们在化学方程式中的化学计量数之比。v(A)=0.6 mol/(L·s),v(B)=0.2 mol/(L·s),v(C)=0.4 mol/(L·s)。化学计量数之比为0.6∶0.2∶0.4,即3∶1∶2。
本题难度:一般
3、选择题 对于可逆反应N2+3H2 2NH3下列各项所表示的反应速率最快的是
2NH3下列各项所表示的反应速率最快的是
A V(N2)=0.01mol/(L·S) B V(H2)=0.2mol/(L·S)
C V(H2)=0.6mol/(L·S) D V(NH3)=1.2mol/(L·S)
参考答案:D
本题解析:将各选项依方程式系数比转变为同一个物质的速率再进行比较即可
本题难度:一般
4、选择题 把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
A.硫酸铜溶液
B.硝酸钠溶液
C.醋酸钠溶液
D.氢氧化钠溶液
参考答案:C
本题解析:
试题分析:A、加入适量的硫酸铜溶液,锌与硫酸铜发生反应生成Cu与Zn形成原电池,加快反应速率,错误;B、加入硝酸钠后溶液中相当于有了硝酸,与锌反应不会生成氢气,氢气的量减少,错误;C、加入醋酸钠后溶液在有醋酸生成,醋酸是弱酸,氢离子浓度减小,氢离子的物质的量不变,反应速率减慢,且不影响氢气的总量,正确;D、加入氢氧化钠溶液,与硫酸反应消耗氢离子,使产生的氢气减少,错误,答案选C。
考点:考查条件对反应速率的影响判断
本题难度:一般
5、填空题 (10分)某同学设计了如图所示的装置(夹持装置已略去)来探究影响化学反应速率的因素。
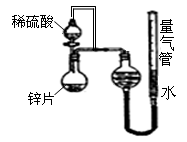
(1)圆底烧瓶中发生反应的离子方程式是
__________________________________________
(2)用上述装置进行实验,以生成15.0mL气体为计时终点,
结果为t1﹥t2
序号
| Ⅴ(H2SO4)/mL
| C(H2SO4)/mol·L-1
| t/s
|
Ⅰ
| 10
| 1
| t1
|
Ⅱ
| 10
| 3
| t2
?
比较实验Ⅰ和实验Ⅱ可以得出的结论是__________________________________________
(3)实验中向烧瓶中滴入的稀硫酸的体积(其他操作都正确),对测定气体体积的影响_____ __________ (填“偏大”、“偏小”、“无影响”)
(4)将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含的杂质可能是(填序号)________
a.石墨????? b.银????? c.铜????? d.沙粒(二氧化硅)
(5)要加快该反应的反应速率,还可以采取的措施有________________________(任填一种即可)
参考答案:(每空2分) (1)Zn+2H+=Zn2++H2↑
(
本题解析:
试题分析:(1)①锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为Zn+2H+=Zn2++H2↑;②t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在其它条件一定时,化学反应速率随反应物浓度的增大而增大,对量气管读数时,要注意调整左右两管的液面高度相平,且视线与液面相平。(3)根据所给装置可以看出实验中向烧瓶中滴入的稀硫酸的体积对测定气体体积无影响;(4)由反应速率大于上述实验对应的数据可知所含杂质必能与锌形成原电池,使反应速率增大,所含杂质可以是石墨、银、铜等;(5)加快该反应的反应速率
本题难度:简单
|