微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2 2SO3,该反应的平衡常数表达式为K=????;过量的SO2与NaOH溶液反应的化学方程式为?????????????????。
2SO3,该反应的平衡常数表达式为K=????;过量的SO2与NaOH溶液反应的化学方程式为?????????????????。
(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是???(??????)
A.玻璃棒
B.烧杯
C.托盘天平
D.500mL量筒
E、500mL容量瓶???? F、胶头滴管
(3)酸溶及后续过程中均需保持盐酸过量,其目的是????????????????????????、
?????????????????????????????????????????????????????????。
(4)通氯气氧化时,发生的主要反应的离子方程式为??????????????????????????;该过程产生的尾气可用碱 溶液吸收,尾气中污染空气的气体为????????????????(写化学式)。
溶液吸收,尾气中污染空气的气体为????????????????(写化学式)。
(5)操作a为?????????????????????????、过滤、洗涤、干燥。
2、选择题 日本地震后,导致福岛第一核电站引发核危机。核反应堆的第一层护罩是锆锡合金外壳,第二层护罩是压力仓,第三层护罩是用最坚固的钢和混凝土制成的非常厚的球体。下列叙述错误的是( )。
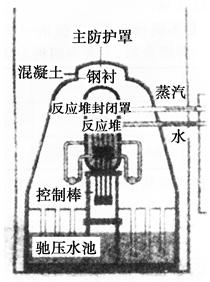
A.锆锡合金、钢、混凝土都属于混合物
B.钢的硬度和熔沸点都高于纯铁
C.锆锡合金和钢属于金属材料,混凝土属于传统的硅酸盐材料
D.在高温下,钢和水蒸气可发生反应产生氢气
3、实验题 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
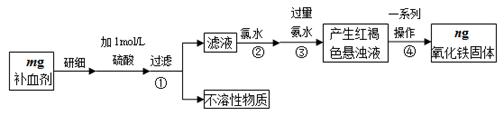
(1)实验中用已经准确量取的浓硫酸配制500 mL 1 mol·L-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要????????????????????????????。
(2)步骤②加入过量氯水后发生反应的离子方程式为?????????????????????????。
(3)步骤④中一系列操作步骤为?????????、洗涤、灼烧、冷却、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为????????????。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1 mol·L-1的硫酸溶液,过滤。取滤液加?????????????? _______________溶液,溶液变红说明该补血剂已部分变质。向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有???????????性(填“氧化”或“还原”)的物质。
(6)下列检验(5)中滤液中是否有Fe2+应选用的试剂是????????。
A.KSCN溶液
B.酸性KMnO4溶液
C.铁粉
D.FeCl3溶液
4、选择题 在氧化铁和盐酸混和溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是
A.H+
B.Fe2+
C.Fe3+
D.Cl-
5、选择题 下列各组物质不能按所示关系实现转化的是表示反应一步完成( )