微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 3molA和2.5molB混合盛入容积为2L的容器内,使它们发生反应2A(s)+3B(g)?????? 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是??????(???)

A.B的平均消耗速率为0.3mol(L·min)
B.C的平衡浓度为2mol/L
C.平衡后,增大压强,平衡将向正方向移动
D.若单位时间内生成的B和C的物质的量之比为3:2,则体系处于平衡状态
参考答案:D
本题解析:
正确答案:D
A.不正确,B的平均消耗速率为1.5mol÷2L÷5MIn=0.15mol(L·min)―1
B.不正确,C的平衡浓度为1mol/2L=0.5mol/L
C.不正确,平衡后,增大压强,平衡不移动,A为固体。
D.正确,若单位时间内生成的B和C的物质的量之比为3:2,即用B表示的逆速率与用C表示的正速率与计量数成比例,则体系处于平衡状态
本题难度:一般
2、选择题 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
参考答案:A
本题解析:根据反应方程式知4v正(O2)=5v逆(NO)表示v正=v逆,所以A正确。生成NO、消耗NH3均为正反应的变化,所以B中叙述未表示逆反应的情况,所以B错误。由于反应物、生成物均为气体,所以增加容器体积,v正、v逆都减小,C错误。v正(NH3)∶v正(H2O)=2∶3,D错误。
本题难度:一般
3、选择题 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
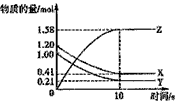 [???? ]
[???? ]
A.反应开始到10s,用Z表示的反应速率为0.158moL/(L·s)
B.l0s后,该反应停止进行
C.反应的化学方程式为:2X(g)+Y(g) 2Z(g)
2Z(g)
D.反应开始到l0s时,平均反应速率 :ν(X)=ν(Y)=0.0395mol/(L·s)
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知:①CO(g)+H2O(g) CO2(g)+H2(g)??ΔH1="-41.2" kJ/mol
CO2(g)+H2(g)??ΔH1="-41.2" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g)???? ΔH2="+247.3" kJ/mol
2CO(g)+2H2(g)???? ΔH2="+247.3" kJ/mol
③CH4(g)+H2O(g) CO(g)+3H2(g)?????ΔH3
CO(g)+3H2(g)?????ΔH3
若反应③在一体积恒定为1 L的密闭容器中进行,测得CH4的物质的量浓度随反应时间的变化如图所示。下列有关叙述错误的是
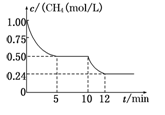
A.ΔH3=+206.1 kJ/mol
B.反应③进行到10 min时,改变的外界条件可能是升高温度
C.反应③进行的过程中,0~5 min这段时间共吸收的热量为103.05 kJ
D.当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大
参考答案:D
本题解析:A、正确,①+②得△H3=-41.2 kJ/mol+247.3 kJ/mol=+206.1 kJ/mol
B、正确,升高温度,平衡正向移动;C、正确,206.1 kJ/mol×0.5mol="103.05" kJ;D、不正确,CH4的转化率将减小。选D。
本题难度:一般
5、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是(?????)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是(?????)

A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
参考答案:D
本题解析:
试题分析:由于铅是固态,往平衡体系中加入金属铅后,平衡不移动,c(Pb2+)不变;往平衡体系中加入少量Sn(NO3)2固体后,平衡向左移动,c(Pb2+)变大;升高温度,平衡体系中c(Pb2+)增大,平衡向左移动,说明该反应是放热反应,即△H﹤0;25℃时,该反应的平衡常数K= =0.22/0.10=2.2,所以选项D正确,答案选D。
=0.22/0.10=2.2,所以选项D正确,答案选D。
点评:该题是2011年福建高考试题。此题虽然是新情景,但题目不偏不怪,只要掌握扎实的基础知识不能灵活运用加快得出正确的答案。
本题难度:一般