微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: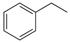 (g)
(g)
 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
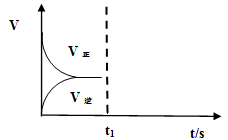
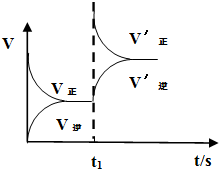
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃
| 700
| 800
| 830
| 1 000
| 1 200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂
参考答案:(1)CO2(g)+ 本题解析: 本题解析:
试题分析:(1)已知反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;反应②: CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;反应②: (g) (g) 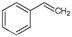 (g)+H2(g),ΔH=" +117.6" kJ/mol;根据盖斯定律:①+②,得 CO2(g)+ (g)+H2(g),ΔH=" +117.6" kJ/mol;根据盖斯定律:①+②,得 CO2(g)+ (g) (g)  (g)+CO(g)+H2O(g),ΔH="+158.8" kJ/mol;反应①与反应②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1?K2; (g)+CO(g)+H2O(g),ΔH="+158.8" kJ/mol;反应①与反应②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1?K2;
(2)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为
 ; ;
(3)平衡时c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则可逆反应2NO2(g) N2O4(g)的平衡常数K= N2O4(g)的平衡常数K= 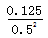 =0.5;根据方程式可知 =0.5;根据方程式可知
2NO2(g) N2O4(g) N2O4(g)
起始浓度(mol/L) 2 0
转化浓度(mol/L) x 0.5x
平衡浓度(mol) 2-x 0.5x
则根据平衡常数可知 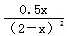 =0.5 =0.5
解得x=1或4,其中x=x舍去
因此NO2的转化率是50%
(4)①根据表中数据可知,随着温度的升高平衡常数逐渐增大。说明升高温度平衡向正反应方向进行,因此正方应是吸热反应。
②A.及时分离出CO气体,平衡向正反应方向进行,但反应速率降低,A错误;B.适当升高温度,反应速率增大,平衡向正反应方向进行,B正确;C.增大CO2的浓度反应速率增大,平衡向正反应方向进行,C正确;D.选择高效催化剂,反应速率增大,但平衡不移动,D错误,答案选BC。
考点:考查盖斯定律的应用、平衡常数计算、外界条件对反应速率和平衡状态的影响
本题难度:困难
2、选择题 相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g) 2SO3(g); 2SO3(g);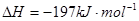 。实验测得起始、平衡时的有关数据如下表: 。实验测得起始、平衡时的有关数据如下表:
容器
| 起始各物质的物质的量/mol
| 达到平衡时体系能量的变化
| SO2
| O2
| SO3
| Ar
| 甲
| 2
| 1
| 0
| 0
| 放出热量:Q1
| 乙
| 1.8
| 0.9
| 0.2
| 0
| 放出热量:Q2
| 丙
| 1.8
| 0.9
| 0.2
| 0.1
| 放出热量:Q3
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
参考答案:B
本题解析:
试题分析:A.这三个反应是在恒温、恒容条件下进行,达到平衡时是等效平衡,由于加入的物质开始不完全相同,所以达到平衡时反应放出的热量不等,而且该反应是可逆反应,不能完全转化,所以三者的关系是A.197 kJ >Q1>Q2=Q3,错误;B.由于物质在气态时含有的能量比固态时高,所以若在上述条件下反应生成2molSO3(s)的反应放出的热量大于197 kJ,因此反应热为△H1,则△H1<-197 kJ/mol,正确; C.化学平衡常数只与温度有关,由于甲、乙、丙3个容器中反应的温度相同,所以平衡常数相等,错误; D.该反应是反应前后气体体积不等的反应,由于达到平衡时是等效平衡,所以平衡时任何反应气体的物质的量相等,在丙中含有惰性气体,所以丙容器中SO2的体积分数最小,错误。
考点:考查等效平衡、反应热与物质的状态的关系的知识。
本题难度:困难
3、填空题 (14分)二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
①CO(g) + 2H2(g) CH3OH(g) △H1=-Q1 kJ·mol-1 CH3OH(g) △H1=-Q1 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1 CH3OCH3(g)+ H2O(g) △H2=-Q2 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-Q3 kJ·mol-1 CO2(g) + H2(g) △H3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g)的热化学方程式为_________。 CH3OCH3(g)+ CO2(g)的热化学方程式为_________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) + 2H2(g) CH3OH (g) △H CH3OH (g) △H
下表所列数据是该反应在不同温度下的化学平衡常数(Κ)。
温度
| 250℃
| 300℃
| 350℃
| K
| 2.041
| 0.270
| 0.012
①由表中数据判断ΔH 0 (填“>”、“=”或“<”)。能够说明某温度下该反应是平衡状态的是
A.体系的压强不变 B.密度不变
C.混合气体的相对分子质量不变 D.c(CO)=c(CH3OH)
②某温度下,将 2mol CO和 6mol H2充入2L的密闭容器中,充分反应 10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K= 。
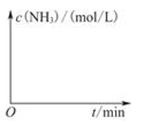
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图。请回答下列问题: 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,在恒容密闭容器中冲入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图。请回答下列问题:
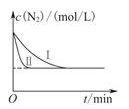
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在下图中画出实验I和实验Ⅲ中NH3浓度随时间变化的示意图。
参考答案:(1)3H2(g)+3CO(g)  本题解析: 本题解析:
试题分析:(1)比较①、②、③和总反应可知将①×2+②+③,可得:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2(g),则△H=-(2Q1+Q2+Q3) kJ/mol;(2)①从表中的数据可以看出温度越高,化学平衡常数越小,说明升高温度,平衡逆向移动,那么该反应的正反应是放热反应,所以ΔH<0;A.该反应是气体体积改变的反应,如果没有达到平衡,那么体系的压强就会发生改变,所以压强不变说明气体的消耗速率和生成速率相等,反应达到了平衡,对;B. 反应体系中物质都是气体,不管在任何时刻气体密度都不变,不能甩密度判断反应是否达到了平衡,错;C.该反应是气体体积改变的反应,如果没有达到平衡,则气体的物质的量就会发生变化,根据M=m/n,物质的量发生改变,气体的相对分子质量就会改变,所以气体的相对分子质量不变,反应达到平衡状态,正确;D. c(CO)=c(CH3OH)不能说明物质的浓度不再改变,不能作判断反应达到了平衡,错;②根据条件可以列出如下方程式: CH3OCH3(g)+ CO2(g),则△H=-(2Q1+Q2+Q3) kJ/mol;(2)①从表中的数据可以看出温度越高,化学平衡常数越小,说明升高温度,平衡逆向移动,那么该反应的正反应是放热反应,所以ΔH<0;A.该反应是气体体积改变的反应,如果没有达到平衡,那么体系的压强就会发生改变,所以压强不变说明气体的消耗速率和生成速率相等,反应达到了平衡,对;B. 反应体系中物质都是气体,不管在任何时刻气体密度都不变,不能甩密度判断反应是否达到了平衡,错;C.该反应是气体体积改变的反应,如果没有达到平衡,则气体的物质的量就会发生变化,根据M=m/n,物质的量发生改变,气体的相对分子质量就会改变,所以气体的相对分子质量不变,反应达到平衡状态,正确;D. c(CO)=c(CH3OH)不能说明物质的浓度不再改变,不能作判断反应达到了平衡,错;②根据条件可以列出如下方程式:
CO(g) + 2H2(g) CH3OH (g) CH3OH (g)
c(起始)mol/L 1 3 0
c(变化)mol/L 0.8 1.6 0.8
c(平衡)mol/L 0.2 1.4 0.8
平衡常数K=c(CH3OH)/c(CO)·c2(H2)=0.8/(0.2×1.42)=2.04;(3)① 从图像可以看出实验Ⅰ和实验Ⅱ相比较,实验Ⅱ反应速率加快了,但是N2平衡浓度相等,说明平衡没有发生移动,所以改变的条件为加入了催化剂;②实验Ⅲ的温度比实验Ⅰ更高,那么达到平衡的时间更短,同时反应是放热反应,升高温度,平衡向逆向移动,NH3浓度更小,平衡时的浓度曲线应该在实验Ⅰ的下方,实验I和实验Ⅲ的NH3浓度随时间变化的示意图如下:
 。 。
考点:盖斯定律的应用、化学平衡状态的判断、化学平衡常数的计算、化学平衡图像的认识和绘制。
本题难度:困难
4、选择题 在一密闭容器中进行下列反应:A(g)+B(g)?2C(?)+D(g),此反应符合下列两个图象,则下列叙述正确的是( ? ) A.正反应为吸热反应,C是固体或液体
B.正反应为吸热反应,C是气体
C.正反应为放热反应,C是气体
D.正反应为放热反应,C是固体或液体
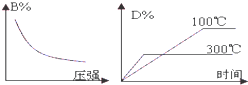
参考答案:D
本题解析:
本题难度:简单
5、选择题 恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
A.若体积减小一半,压强增大,V正增大,V逆减小
B.平衡向右移动,混合气体颜色一定会变浅
C.若体积减小一半,压强增大,但小于原来的两倍
D.平衡向右移动,混合气体的平均相对分子量减小
参考答案:将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|