微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 当用酸滴定碱时,下列操作中会使测定结果(碱的浓度)偏低的是(??)
A.酸式滴定管滴至终点后,俯视读数
B.碱液移入锥形瓶后,加了10mL蒸馏水在滴定
C.酸式滴定管用蒸馏水润洗后,未用标准液润洗
D.酸式滴定管注入酸液后,尖嘴留有气泡即开始滴定,滴定终点时气泡消失
2、选择题 已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的
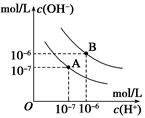
A.A曲线代表25℃时水的电离平衡曲线
B.当95℃时,pH=6的溶液呈中性
C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸
3、填空题 已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) △H1=-285.8kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-110.5kJ ·mol-1
④C(s) +O2(g)=CO2(g) △H4=-393.5kJ·mol-1
回答下列各问:
(1)上述反应中属于放热反应的是______________。
(2) H2的燃烧热为______________;C的燃烧热为________________。
(3)燃烧10g H2生成液态水,放出的热量为_______________。
(4)写出碳和水蒸气反应生成CO(g)、H2 (g)的热化学方程式________________。
4、实验题 (14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)锥形瓶中的溶液从_____色变为_____色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注视________????????_;
(3)该小组在步骤①中的错误是_?????????????????___,由此造成的测定结果_____(填偏高、偏低或无影响);
(4)步骤②缺少的操作是_______????????___;
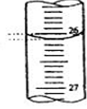
(5)如图,是某次滴定时滴定管中的液面,其读数为????????mL
(6)根据下列数据:
滴定次数
| 待测液体(mL)
| 标准盐酸体积(mL)
|
滴定前读(mL)
| 滴定后读数(mL)
|
第一次
| 25.00
| 0.50
| 20.40
|
第二次
| 25.00
| 4.00
| 24.10
|
第三次
| 25.00
| 0.80
| 23.10
请选用合理的数据计算待测烧碱溶液的浓度为_______?mol/L
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥?????????????? ???????????????????
C.酸式滴定管在滴定前有气泡,滴定后气泡消失????????????????????????????????
D.读取盐酸体积时,滴定结束时俯视读数
5、选择题 下列关于热化学反应的描述中正确的是[???? ]
A.盐酸和氢氧化钠反应的中和热△H=-57.3kJ·mol-1,则1molH2SO4和足量NaOH在稀溶液中反应的反应热△H=-57.3kJ·mol-1
B.需要加热才能发生的反应一定是吸热反应
C.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.CO(g)的燃烧热△H=-283.0kJ·mol-1,则反应2CO2(g)=2CO(g)+O2(g) ;△H=+2×283.0kJ·mol-1
|