微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (2014届上海市八校高三年级联合调研考试化学试卷)
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下:?
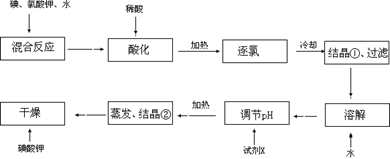
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是????????????????????。
(2)X的化学式为??????????;写出用试剂X调节pH的化学方程式:?????????????。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响???????????????。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O;? I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有?????????????????????????。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是?????????????mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
操作步骤
| 实验现象
|
取1g纯净的NaCl,加3mL水配成溶液。
| 溶液无变化
|
滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。
| 溶液无变化
|
然后再滴入1滴1mol·L-1的H2SO4,振荡。
| 溶液变蓝色
?
①推测实验中产生蓝色现象的可能原因,用离子方程式表示?????????。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:?????????????。
参考答案:
(1)有两种还原产物生成。
(2)KOH;?
本题解析:
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该反应是氧化还原反应,由于在氧化还原反应中电子转移数目相等,而有两种还原产物生成。它们相对量的多少不同,配平时的系数就不同。因此在该方程式配平时,系数有多组。
(2)晶体①为KH(IO3)2,把晶体从溶液中过滤出来,洗涤干净,然后用水溶解得到KH(IO3)2的溶液,要把酸式盐变为正盐KIO3,就要加碱来调节溶液的pH值。为了不引入新的杂质,所以要用KOH。该反应的方程式为KH(IO3)
本题难度:一般
2、填空题 (1)已知亚氯酸(HclO2)不稳定,可分解,分解反应的离子方程式为:
HClO2→ClO2↑+H++Cl-+H2O(未配平)。当有3.2mol电子发生转移时,发生分解的HClO2的物质的量是?????????。
(2)有Fe2+、NO-3、Fe3+、NH+4、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中氧化剂与还原剂的物质的量之比为?????????????。
参考答案:(1)4mol(2分,不带单位不得分)
(2)1:8(
本题解析:略
本题难度:简单
3、选择题 下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,只能做氧化剂
B.
3517
Cl、
3717
Cl为氯元素的两种同位素,化学性质不同
C.1.12L Cl2含有1.7NA个质子(NA表示阿伏伽德罗常数)
D.实验室制备Cl2,可用排饱和食盐水集气法收集
参考答案:A.氯气中氯元素化合价是0价,所以氯气有还原性,氯气和水、氢
本题解析:
本题难度:简单
4、填空题 (16分)
(1)下图为实验室制备、收集少量HCl的装置。
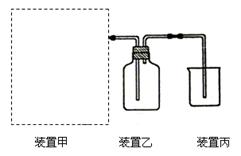
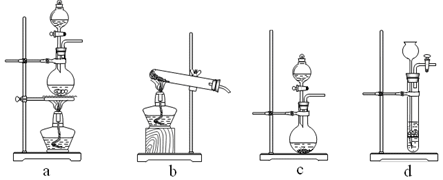
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的???????。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因??????????????????????????????。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和??????????。
(2)以下为苯的取代反应的探究实验。
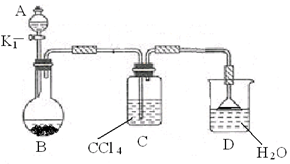
① 按上图所示的装置图连接好各仪器。
② 检验装置的气密性。
③ 在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式?????????????????????????????????????????????。
装置C的作用是???????????????????????????。
④ 反应结束后,用试管取少量D中的溶液,加入?????????????????????????????????????
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤ 把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。
其中试剂为 ??????????,操作名称为??????????。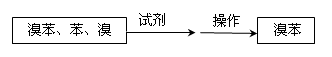
参考答案:(16分,每空2分)
(1)① c
② 浓硫酸具
本题解析:
试题分析:(1)①利用浓硫酸与水混合时放热及浓盐酸的挥发性制取少量氯化氢,不需加热,所以选择c装置;
②利用了浓硫酸和浓盐酸的特性,浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体;
③为防止倒吸,除加入水外,还应加入比水密度大且氯化氢不溶于其中的液体物质,所以选择CCl4;
(2)③B中发生苯与溴在催化剂的作用下生成溴苯的反应,化学方程式为 本题难度:一般 本题难度:一般
5、选择题 如图:A处通入氯气.关闭B阀时,C处红色布条无变化,打开B阀时,C处红色布条褪色.由此作出的判断正确的是( )
A.D中不可以是浓硫酸
B.D中可以是水
C.D中可以是饱和食盐水
D.通入的氯气含有水份
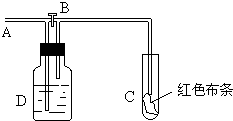
参考答案:D
本题解析:
本题难度:简单
|
网站客服QQ: 960335752 - 14613519 - 791315772