微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu 2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下:

①第(
2、选择题 氢氧燃料电池是一种高性能电池,总反应为2 H2 + O2 =" 2" H2O,电解质溶液为KOH溶液,下列有关该电池的叙述中不正确的是(???? )
A.H2为负极,O2为正极
B.工作时电解质溶液的PH不断增大
C.负极反应:2H2-4e- +4OH-=4H2O
D.正极反应:O2 + 4e- +2 H2O=4OH-
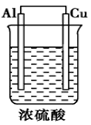
3、填空题 如下图由浓硫酸、Cu、Al组成一个原电池,试写出正、负极电极反应式,并指出反应类型。
负极:_______________;____________;
正极:_______________;____________。
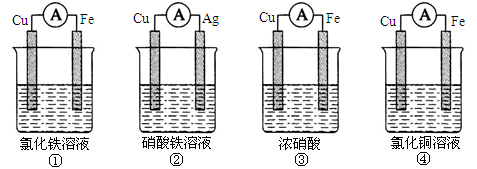
4、填空题 (10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
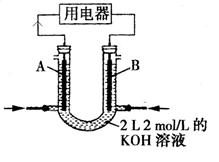
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
5、填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:? CO(g) + 2H2(g)? ??CH3OH(g)????ΔH1
??CH3OH(g)????ΔH1
反应II: CO2(g) + 3H2(g)  ??CH3OH(g)? +? H2O(g)?ΔH2
??CH3OH(g)? +? H2O(g)?ΔH2
① 上述反应符合“原子经济”原则的是?????(填“I”或“Ⅱ”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
由表中数据判断ΔH1??????0 (填“>”、“=”或“<”)。?????
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)?
ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g)?ΔH =-566.0 kJ/mol
③ H2O(g)= H2O(l)??ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol CO和液态水放出的热量为?????????
(3)利用甲醇燃料电池设计如右图所示的装置:

则该装置中Cu极为???????极;
写出b极的电极反应式?????????????。
|