微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 FeCl3溶液与Fe(OH)3胶体具有的共同性质是
A.分散质粒子直径都在1 mm~100 nm之间
B.都能透过半透膜
C.加热蒸干后都有Fe2O3生成
D.呈红褐色
参考答案:C
本题解析:因FeCl3溶液中Fe3+、Cl-的直径均小于1 nm,Fe(OH)3胶粒的直径在1~100 nm之间,故A项错.Fe(OH)3溶胶属胶体,Fe(OH)3胶粒不能透过半透膜,B项错.FeCl3溶液为棕黄色,D项错.FeCl3溶液加热时会水解生成Fe(OH)3沉淀,蒸干后Fe(OH)3会逐渐分解生成Fe2O3,Fe(OH)3溶胶加热蒸干后也会生成Fe2O3.
本题难度:简单
2、选择题 一定温度下,某NaCl稀溶液中[H+]为1×10-6?mol·L-1,下列说法正确的是
A.该NaCl溶液显酸性
B.该NaCl溶液中Kw=1×10-14
C.该NaCl溶液稀释10倍后pH=7
D.该NaCl溶液中Kw=1×10-12
参考答案:D
本题解析:正确答案:D水电离的H+和OH―浓度相等,该NaCl溶液中Kw=1×10-6 ×1×10-6 =1×10-12
本题难度:一般
3、选择题 在0.1mol/L的NH4HSO4溶液中,下列微粒的物质的量浓度关系正确的是
A.c(H+) = c(SO42-) > c(NH4+)
B.c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-)
C.c(H+) = c(NH4+) + c(NH3?H2O) + c(OH-)
D.室温下滴加NaOH溶液至中性后:c(Na+) > c(SO42-) > c(NH4+) > c(OH-) = c(H+)
参考答案:BD
本题解析:试题分析:A、HSO- 4完全电离,NH4+会部分水解产生H+,c(H+) > c(SO42-) > c NH4+),错误;B、根据溶液中电荷守恒,c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-),正确;C、由电荷守恒,c(NH4+) + c(H+) =" 2" c(SO42-) + c(OH-),物料守恒:c(NH4+) + c(NH3?H2O)= c(SO42-),可知质子守恒为c(H+) = c(NH4+) + 2c(NH3?H2O) + c(OH-),错误;D、若两者1:1反应得到等浓度硫酸铵和硫酸钠混合溶液,NH4+会部分水解产生H+,此时c(Na+) > c(SO42-) > c(NH4+) > c(H+)>c(OH-),若要显中性,需再滴加NaOH溶液,故c(Na+) > c(SO42-) > c(NH4+) > c(OH-) = c(H+),正确。
考点:考查溶液中粒子浓度关系。
本题难度:一般
4、选择题 向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,黑色沉淀为CuS
B.上述现象说明ZnS的Ksp小于CuS的Ksp
C.利用该原理可实现一种沉淀转化为更难溶的沉淀
D.该过程破坏了ZnS的溶解平衡
参考答案:B
本题解析:ZnSO4+Na2S=ZnS↓+Na2SO4? ZnS+CuSO4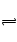 CuS+ZnSO4,A正确,先得到白色沉淀,后转化为黑色沉淀,C、D正确,B、不正确,ZnS的Ksp大于CuS的Ksp,CuS更难溶。
CuS+ZnSO4,A正确,先得到白色沉淀,后转化为黑色沉淀,C、D正确,B、不正确,ZnS的Ksp大于CuS的Ksp,CuS更难溶。
本题难度:困难
5、选择题 常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是??????

A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
参考答案:B
本题解析:当NaOH溶液和醋酸恰好完全反应时,生成醋酸钠水解而使溶液显碱性,故A错。当pH<7时有c(H+)>c(OH-),根据电荷守恒可得c(CH3COO-)>c(Na+),故B正确。当7<pH<13时,溶液也有c(Na+)> c(OH-)> c(CH3COO-)>c(H+)这一种情况,C错。对于选项D可作一极端设想,若溶液就是0.1 mol·L-1醋酸,由于醋酸是弱酸,溶液的pH也大于1,故D也错。
本题难度:一般