微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于(??? )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:C
本题解析:
试题分析:氢氧化钡是二元强碱,所以氢氧化钡是过量的,则反应后OH-的浓度是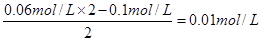 。则根据水的离子积常数可知,溶液中氢离子的浓度是1×10-12mol/L,所以pH=12,答案选C。
。则根据水的离子积常数可知,溶液中氢离子的浓度是1×10-12mol/L,所以pH=12,答案选C。
点评:该题是高考中的常见考点,属于中等难度的试题。该题的关键是首先判断酸碱的过量问题,特别需要注意的是,如果碱过量,则 首先
本题难度:一般
2、选择题 已知常温下,0.1mol/L的一元酸HA溶液的pH>1;0.1mol/L的一元碱MOH溶液中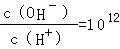 ,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
,将此两种溶液等体积混合,混合夜中,离子浓度关系不正确的是( )
A.c(OH﹣)=c(HA)+c(H+)
B.c(M+)>c(A﹣)>c(OH﹣)>c(H+)
C.c(A﹣)>c(M+)>c(H+)>c(OH﹣)
D.c(M+)+c(H+)=c(A﹣)+c(OH﹣)
参考答案:C
本题解析:
试题分析:0.1mol/L的一元酸HA溶液的pH>1,则酸部分电离,为弱酸;0.1mol/L的一元碱MOH溶液中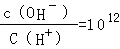 ,结合水的离子积常数知,
,结合水的离子积常数知,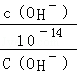 本题难度:一般
本题难度:一般
3、选择题 科学家预测“氢能”将是21世纪最理想的新能源。化学家提出“硫-碘热循环法”制氢气,总反应方程式为: ,其循环过程分三步进行:
,其循环过程分三步进行:
(a) SO2+I2+2H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O。
下列分析不合理的是 (??? )
A.由于硫酸很稳定,所以反应(c)最难进行
B.该循环过程不需加热,常温下就能进行
C.反应生成的SO2和I2可以循环使用
D.“硫-碘热循环法”耗能大,若利用太阳能,可大面积推广
参考答案:B
本题解析:由于硫酸很稳定,所以循环过程c反应很难进行,致使这个制氢气的总反应在常温下并不能进行,需要提供能量才可,故B描述不合理。
本题难度:一般
4、选择题 常温下,将0.1 mol·L-1NaOH溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:B
本题解析:考查pH的有关计算。氢离子的浓度是0.12mol/L,所以硫酸过量,反应后溶液中氢离子浓度是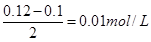 ,所以pH=2,答案选B。
,所以pH=2,答案选B。
本题难度:一般
5、填空题 (8分)已知下列热化学方程式:①2H2(g) +O2(g)=2H2O(l);ΔH= -570 kJ·mol-1
②2H2(g) +O2(g)=2H2O(g) ΔH= -483.68 kJ·mol-1
③2C(s) +O2(g)=2CO(g) ΔH=-221 kJ·mol-1
④ C(s) +O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为 ;C的燃烧热为 。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
参考答案:(1)285KJ/mol、393.5KJ/mol
本题解析:(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。所以氢气的燃烧热是285KJ/mol。C的燃烧热为393.5KJ/mol。
(2)10g氢气是5mol,放出的热量是285KJ/mol×5mol=1425KJ。
(3)④×2-③得到2CO(g) +O2(g)=2CO2(g) ΔH= -566 kJ·mol-1 。
本题难度:一般