微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 运用盖斯定律可计算一些不易测定的反应的反应热.
(1)已知在298K时下述反应的有关数据:C(s)+
1
2
O2(g)=CO(g)△H1=-110.5kJ-mol-1,C(s)+O2(g)=CO2(g)△H2=-393.5kJ-mol-1.则C(s)+CO2(g)=2CO(g)?的△H为______.
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ-mol-l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ-mol-l.则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为______.
参考答案:(1)已知:①、C(s)+
本题解析:
本题难度:简单
2、选择题 已知①2C(s)+O2(g) 2CO(g) ΔH="-221.0" kJ·mol-1 2CO(g) ΔH="-221.0" kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ·mol-1 2H2O(g) ΔH="-483.6" kJ·mol-1
则反应C(s)+H2O(g) CO(g)+H2(g)的ΔH为( ) CO(g)+H2(g)的ΔH为( )
A.+131.3 kJ·mol-1
B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1
D.+262.6 kJ·mol-1
参考答案:A
本题解析:把方程式(①-②)/2,得出C(s)+H2O(g) CO(g)+H2(g) ΔH="(-221.0" kJ·mol-1+483.6 kJ·mol-1)/2="+131.3" kJ·mol-1,所以选A。 CO(g)+H2(g) ΔH="(-221.0" kJ·mol-1+483.6 kJ·mol-1)/2="+131.3" kJ·mol-1,所以选A。
本题难度:一般
3、简答题 一种混合动力车,可以分别用电动机、内燃机或者二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车和下坡时内燃机提供推动力,使电动机处于充电状态.目前内燃机以汽油为燃料,电动机一般使用镍氢电池(KOH作电解液).
试分析回答下列问题:
(1)已知汽车在刹车和下坡时,镍氢电池两电极反应分别为:甲电极:M+H2O+e-→MH+OH-(M为储氢合金,MH为吸附了氢原子的储氢合金)乙电极:Ni(OH)2+OH--e-→NiOOH+H2O则在这一过程中甲、乙两电极的名称分别是:甲:______;乙:______.
(2)当汽车上坡或加速时,镍氢电池两电极反应分别为:甲电极:______;乙电极:______;电极周围溶液的pH变化是(选填“增大”或“不变”或“减小“,下同)甲______;乙______.
(3)内燃机工作时因为部分汽油不完全燃烧会产生污染大气的CO,已知在常温常压下:
C8?H18(1)+25/2O2(g)=8CO2(g)+9H2O(g);△H=-5121.9kJ/mol
2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
H2O(g)=H2?O(1);△H=-44.0kJ/mol
写出汽油不完全燃烧生成一氧化碳和液态水的热化学方程式:______.
(4)为降低汽车尾气中的一氧化碳的浓度,可采取在汽车的排气管上增加一个补燃器,通过下列反应来实现转化:
2CO(g)+O2(g)?2CO2(g)
已知在温度为T的条件下,当补燃器中化学反应速率V(正)=V(逆)时,各物质浓度存在下列恒定关系: c(CO2)2
c(CO)2×c(O2)
=108
在温度为T的条件下,若某汽车排人补燃器的CO、CO2的浓度分别为1.0×10-5mol?L-1和1.01×10-4mol?L-1,要在该温度下使最终尾气中CO的浓度降为1.0×10-6mol?L-1,则补燃器中应不断补充O2,并使O2浓度保持在______mol?L-1.
参考答案:(1)在刹车和下坡时内燃机提供推动力,使电动机处于充电状态,
本题解析:
本题难度:一般
4、选择题 氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1 ClO+O=Cl+O2ΔH2
该反应的能量变化如图示意,下列叙述中正确的是
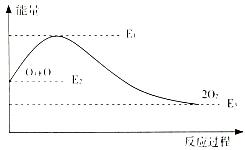
A.反应O3+ O=2O2的ΔH=E1-E2
B.反应O3+ O=2O2的ΔH=E2-E3
C.反应O3+ O= 2O2是吸热反应
D.反应O3+ O=2O2的ΔH=ΔH1+ΔH2
参考答案:D
本题解析:
试题分析:将①式O3+Cl=ClO+O2 ΔH1与②式ClO+O=Cl+O2ΔH2相加,整理可得:反应O3+ O=2O2 的ΔH=ΔH1+ΔH2。由于反应物的总能量高于生成物的总能量。所以反应反应O3+ O=2O2为放热反应。因此正确选项为D。
考点:考查盖斯定律的应用及反应是放热反应还是吸热反应的知识。
本题难度:一般
5、选择题 下列有关热化学方程式的叙述正确的是[???? ]
A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq) + CH3COOH(aq) = CH3COONa(aq) + H2O(l) ; △H =-57.4kJ·mol-1
B.已知C(石墨,s)= C(金刚石,s);△H>0,则石墨比金刚石稳定
C.已知反应2H2(g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2??
参考答案:BC
本题解析:
本题难度:简单
|
|