微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下为在浓盐酸中H3AsO3与SnCl2反应的离子方程式,关于该反应的说法正确的组合是:( )
a SnCl2+b Cl-+c H3AsO3+d H+=e As+f SnCl62-+g M
①氧化剂是H3AsO3; ②M为OH-;
③每生成7.5gAs,还原剂失去的电子为0.3 mol; ④ SnCl62-是氧化产物。
A.①③④
B.①②④
C.①②③④
D.只有①③
参考答案:A
本题解析:Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3;
由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O
故每生成7.5gAs,还原剂SnCl2失去的电子为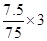 =0.3mol
=0.3mol
由于溶液为强酸性溶液,M不可能为OH—,排除②
答案为A
本题难度:一般
2、选择题 下列反应中,是非氧化还原反应的是
①H2+C12 2HCl
2HCl
②A12O3+2NaOH=2NaAlO2+H2O
③2HgO 2Hg+O2↑
2Hg+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤MnO2+4HCl MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
A.②④
B.①③
C.①②③
D.②④⑤
参考答案:A
本题解析:氧化还原反应的判断依据,有无化合价的改变,凡有化合价改变的反应,均属于氧化还原反应。②④反应前后化合价均没变,属于非氧化还原。
本题难度:简单
3、选择题 亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
Li2NH+H2 LiNH2+LiH,下列有关说法正确的是(???)
LiNH2+LiH,下列有关说法正确的是(???)
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
参考答案:B
本题解析:
试题分析:A.在Li2NH中N的化合价是-3价。错误。 B.该反应中H2一部分变为LiNH2中的+1价的氢,一部分变为LiH中的-1价的氢。所以H2既是氧化剂又是还原剂。正确。C.Li+和H-的离子电子层结构相同,但由于核电荷数Li+>H-。核电荷数越大,离子半径就越小。所以离子半径不相等。错误。D.此法储氢是化学储氢;钢瓶储氢是把氢气加压降温使之变为液态。储氢原理并不相同。错误。2NH)的结构和性质的知识。
本题难度:一般
4、选择题 下列化学用语书写正确的是(???? )
A.中子数为10的氧原子:108O
B.亚硫酸铵的化学式:(NH3) 2SO3
C.碳酸钾的电离方程式:K2CO3=2K+1 + CO3-2
D.硫离子的结构示意图为:
参考答案:D
本题解析:
试题分析:A选项左上角是质量数,应为18,错误。B选项亚硫酸铵化学式为:(NH4)2SO3,错误。C选项离子的电荷应表示为K+, CO32-,错误。D选项正确。
本题难度:一般
5、填空题 (1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+ +H2SO4—→ + + + +H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则①Br2的化学计量数是 ;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
KBrO3+ + H2SO4—→……;
③若转移10 mol电子,则反应后生成I2的物质的量为 。
参考答案:(1)KI I2 Br2 K2SO4 KBr
(2)①
本题解析:(1)根据KBrO3在反应后Br元素的化合价降低,知其作氧化剂,则需填入还原剂KI,故所得的未配平的化学方程式为KBrO3+KI+H2SO4—→I2+Br2+K2SO4+KBr+H2O。
(2)①如果I2的化学计量数是8,KBr的化学计量数是1,则根据碘元素化合价变化知共失电子16 mol,KBr的化学计量数是1,得电子为6 mol,则KBrO3→Br2共得电子10 mol,即Br2的化学计量数为1;②由①中变化可知,KI的化学计量数为16,KBrO3的化学计量数为3,再根据K原子守恒推出K2SO4的化学计量数为9,所以H2SO4的化学计量数为9,即3KBrO3+16KI+9H2SO4=8I2+Br2+9K2SO4+KBr+9H2O;③若转移10 mol电子,
则16KI ~ 16e- ~ 8I2
10 y
解得y=5 mol。
本题难度:一般