微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在甲酸的下列性质中,可以证明它是弱电解质的是
A.1mol/L的甲酸溶液中c(H+)约为1×10-2 mol/L
B.甲酸能与水以任意比例互溶
C.1mol/L的甲酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应
D.甲酸溶液的导电性比盐酸弱
参考答案:A
本题解析:
试题分析:
A、甲酸是一元酸,氢离子浓度小于酸的浓度,说明甲酸不能完全电离,肯定是弱电解质,故A符合题意;
B、溶解性与电解质强弱无关,故B不合题意;
C、酸碱是否恰好完全反应与强弱无关,故C不合题意;
D、未指明是否是相同浓度的两种酸,仅从导电性上不能证明两种酸的强弱,故D不合题意。
考点:弱电解质的判断依据
点评:本题考查了弱电解质的判断依据,难度不大。解题时抓住一个关键,要证明一种酸是弱酸,就要证明它不完全电离。要尤其注意的是,电解质的强弱与溶解性、导电性没有必然的联系。
本题难度:一般
2、选择题 用水稀释0.5mol?L-1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是( )
①H+的物质的量
②C(H+)
③C(H+)/C(CH3COO-)
④C(CH3COOH)/C(CH3COO-)
⑤C(OH-)
A.①③⑤
B.①④⑤
C.②④
D.③④
参考答案:醋酸(CH3COOH)溶液中醋酸是弱电解质存在电离平衡,CH
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是[???? ]
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中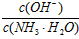 增大
增大
参考答案:C
本题解析:
本题难度:一般
4、选择题 当NaOH溶液与氨水的pH、体积都相同时,下列叙述正确的是[???? ]
A.两溶液的物质的量浓度相同
B.两溶液的c(H+)相同
C.用同浓度盐酸中和时,消耗酸的体积相同
D.升高温度10℃,两者pH仍相等
参考答案:B
本题解析:
本题难度:一般
5、简答题 氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产.氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度.Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值.
下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
[仪器与试剂]酸度计、50mL碱式滴定管、100mL烧杯、0.10mol?L-1?氨水
[实验数据](不必填表格)
| 烧杯号 | V氨水?(mL) | V水(mL) | c?(NH3?H2O)?(mol?L-1) | c(OH-) | Kb | α
1
50.00
0.00
1.34×10-3
2
25.00
25.00
9.48×10-4
3
5.00
45.00
4.24×10-4
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb≈______,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系______
(2)用0.10mol?L-1盐酸分别滴定20.00mL0.10mol?L-1的NaOH溶液和20.00mL0.10mol?L-1氨水所得的滴定曲线如下:
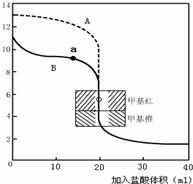
请指出盐酸滴定氨水的曲线为______(填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序______.
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=______.
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料.其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+
2H2O+4e-=4OH-,则负极上的电极反应式为______.
参考答案:(1)由NH3?H2O═NH4++OH-,第一组实验中的Kb
本题解析:
本题难度:一般
|