微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
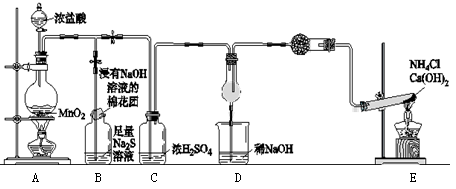
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫原因 。
(4)D中干燥管中出现的现象及化学方程式 ; 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该洗气装置中盛装 试剂。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明 。
参考答案:(1)MnO2 + 4H+ + 2Cl- ="===" Mn
本题解析:
试题解析:(1)反应装置A为浓盐酸和二氧化锰共热制备氯气的装置,其离子方程式为:MnO2+4H++2Cl-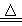 Mn2++Cl2↑+2H2O;(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2-=S↓+2Cl-;(3)氯原子最外层有7个电子,硫原子最外层有6个电子,最外层电子多(不为8)得电子能力就强,得电子能力强则氧化性强,故答案为:氯原子最外层电子数比硫原子多一个,Cl得电子能力强,故Cl2氧化性大于S;(4)通E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此实验的现象是产生大量白烟,反应的方程式是8NH3+3Cl2=6NH4Cl+N2;(5)盐酸易挥发,所以生成氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接一盛有饱和食盐水的装置以除去氯化氢气体;(6)非金属性强弱比较的一般规律是:①由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.②由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).③非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证,用一种相关事实说明为2Fe + 3Cl2 ="===" 2FeCl3、Fe+S
Mn2++Cl2↑+2H2O;(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2-=S↓+2Cl-;(3)氯原子最外层有7个电子,硫原子最外层有6个电子,最外层电子多(不为8)得电子能力就强,得电子能力强则氧化性强,故答案为:氯原子最外层电子数比硫原子多一个,Cl得电子能力强,故Cl2氧化性大于S;(4)通E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此实验的现象是产生大量白烟,反应的方程式是8NH3+3Cl2=6NH4Cl+N2;(5)盐酸易挥发,所以生成氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接一盛有饱和食盐水的装置以除去氯化氢气体;(6)非金属性强弱比较的一般规律是:①由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.②由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).③非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证,用一种相关事实说明为2Fe + 3Cl2 ="===" 2FeCl3、Fe+S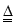 FeS。
FeS。
考点:非金属在元素周期表中的位置及其性质递变的规律
本题难度:一般
2、选择题 物质氧化性、还原性的强弱,不仅与物质的结构有关,而且还与物质浓度、反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Fe与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,
由于浓度不同而发生不同氧化还原反应的是 [???? ]
A.①③
B.②④
C.②③
D.③④
参考答案:A
本题解析:
本题难度:一般
3、选择题 已知下列三个反应:2Fe2++Cl2 == 2Fe3++2Cl-,2Fe3++Cu == 2Fe2++Cu2+,Fe+Cu2+ == Fe2++Cu 试推断结论:具有还原性物质的还原性强弱:①Fe>Cu>Fe2+>Cl- ②Cl->Fe2+>Fe>Cu 具有氧化性物质的氧化性强弱:③Fe3+>Cl2>Fe2+>Cu2+ ④Cl2>Fe3+>Cu2+>Fe2+其中结论正确的是
[???? ]
A.①③
B.②③
C.①④
D.②④
参考答案:C
本题解析:
本题难度:一般
4、选择题 半径由小到大、氧化性由强到弱的一组微粒是
A.H+、Al3+、Mg2+、K+
B.O、P、S、Cl
C.S2-、Cl-、K+、Ca2+?
D.Na、Mg、Al、K
参考答案:A
本题解析:微粒半径判定规则:电子层数越大半径越大,层数相同时,核电荷数越大,半径越小;由些即可排除BCD,答案A符合题意
本题难度:一般
5、选择题 已知:①2BrO3-+Cl2=Br2+2ClO3-,②5Cl2+I2+6H2O=2HIO3+10HCl,③ClO3-+5Cl-+6H+=3Cl2+3H2O.下列离子氧化性正确的是( )
A.ClO3->BrO3->IO3->Cl2
B.IO3-<ClO3-<BrO3-<Cl2
C.IO3-<BrO3-<Cl2<ClO3-
D.BrO3->ClO3->Cl2>IO3-
参考答案:①中BrO3-是氧化剂,ClO3-是氧化产物,所以氧化性Br
本题解析:
本题难度:一般