微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于物质结构的说法中正确的是
[ ??? ]
A.BF3、HClO分子中所有原子都满足最外层8电子结构
B.水分子空间构型呈V形,氨分子呈三角锥形
C.D2O分子与H2O分子是所含电子总数不相等的分子
D.在任何物质分子中都含有化学键
参考答案:B
本题解析:
本题难度:一般
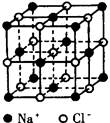
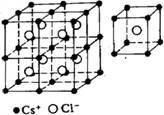
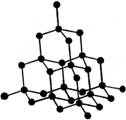
2、填空题 (11分)下图分别为NaCl、CsCl及金刚石的晶体结构模型。
 ??????????
?????????? ???????
??????? ????????????
????????????
⑴ 在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共有_____个。在一个NaCl晶胞中,Cl-离子的个数等于________,Na+离子的个数等于________。
⑵ 在CsCl晶体中,每个Cs+离子周围与它最接近的且距离相等的Cs+离子共有_____个。每个Cs+离子周围与它最接近的且距离相等的Cl-离子共有_____个。
⑶ 在金刚石晶体中,每个C原子周围有________个C—C键,1 mol金刚石,含 C—C键________mol。
⑷ 如果将金刚石晶体结构模型中的C原子换成Si原子,并在每个Si—Si键中间插入O原子就成了SiO2的晶体结构模型。那么在SiO2晶体中,每个Si原子周围有______个O原子,每个O原子_______个Si原子;每个Si原子周围有_______个Si—O键,1mol SiO2中含有_____mol Si—O键。
参考答案:
⑴12? 4? 4????⑵ 6? 8???⑶ 4?
本题解析:⑴在NaCl晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+离子共12个,同层四个,上层四个,下层四个;用均摊法来分析,顶点占1/8,面心占1/2,棱上中心占1/4,体心占1;Cl-离子的个数=1+12х1/4=4,Na+离子的个数=8х1/8+6х1/2=4;
⑵在CsCl晶体中,每个Cs+离子周围与它最接近的且距离相等的Cs+离子共有6个,前后左右上下;
⑶在金刚石晶体中,每个C原子周围有4个C,每个C-C键为两个C相共用,含2mol C—C键;
⑷那么在SiO2晶体中,
本题难度:一般
3、选择题 下列描述中正确的是( )
A.CS2分子的立体结构为V形
B.SiF4和SO32-的中心原子均为sp2杂化
C.SF6中有6对完全相同的成键电子对
D.ClO3-的空间构型为平面三角形
参考答案:C
本题解析:
本题难度:一般
4、填空题 (11分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V cm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________
________________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
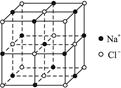
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数Na的表达式为Na=
__________。
参考答案:(2)①容量瓶(2分) ②酸式滴定管 苯通常溶解碱式滴定管的
本题解析:(2)准确配制一定物质的量浓度溶液的仪器是容量瓶;苯是一种有机溶剂,能溶解橡皮,所以要用酸式滴定管;由于需要准确量取苯的体积,所以不能用胶头滴管代替酸式滴定管。根据晶胞的结构可知,该晶胞中含有的钠离子和氯离子均是4个,晶胞的边长是2a,所以有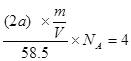 ,解得
,解得 本题难度:一般
本题难度:一般
5、简答题 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的______区;溴的价电子排布式为______.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是______.
(3)请根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______.
| 氟 | 氯 | 溴 | 碘 | 铍
第一电离能
(kJ/mol)
1681
1251
1140
1008
900
(4)已知高碘酸有两种形式,化学式分别为H5IO6(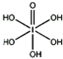 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”) )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6______HIO4.(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列______式发生.
A.CsICl2=CsCl+IClB.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为______,写出一个ClO2-的等电子体______.
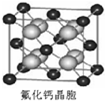
(7)已知CaF2晶体(见图)的密度为ρg?cm-3,NA为阿伏加德罗常数,最近相邻的两个Ca2+的核间距为acm,则CaF2的相对分子质量可以表示为______.
参考答案:(1)根据构造原理知,卤族元素最后填入的电子为p电子,所以卤
本题解析:
本题难度:一般
|