微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质熔点高低的比较,正确的是
A.Al>Mg>Na
B.MgO>KCl>NaCl
C.晶体硅>金刚石>碳化硅
D.AsH3>PH3>NH3
2、填空题 在离子晶体中,阴、阳离子按一定规律在空间排列,如图左图所示为NaCl的晶体结构图。在离子晶体中,阴、阳离子具有或接近具有球对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如图所示)。离子键的键长是相邻阴、阳离子的半径之和,已知a为常数。

试回答下列问题。
(1)在NaCl晶体中,每个Na+同时吸引_____个Cl-,而Na+数目与Cl-数目之比为_____。
(2)NaCl晶体离子键的键长为_____。
(3)Na+半径与Cl-半径之比r(Na+)/r(Cl-)=_______。
(已知:?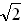 = 1.414,?
= 1.414,? =1.732,?
=1.732,?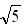 =2.236)
=2.236)
(4)NaCl中晶体不存在分子,但在温度达到1?413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25g?NaCl晶体,加强热使温度达到1?450℃,测得气体体积为5.6?L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
3、填空题 根据下图回答问题:
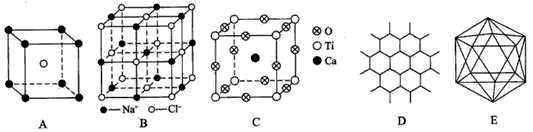
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离子位于8个顶 点,该化合物中阳、阴离子的个数比是____。
(2)B图表示构成NaCl晶体的一个晶胞,通过想象与推理,可确定一个NaCl晶胞中含Na+和Cl-的个数分别为____、______。
(3)钇钡铜复合氧化物超导体有着与钙钛矿型相关的晶体结构,若Ca、Ti、O结构如C图所示的晶体,其 化学式为____。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为____,C-C键个数为____。
(5)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如E图所示。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察E图,推断这个基本结构单元所含硼原子个数、键角、B-B键的个数依次为____、____、____。
4、填空题 肉眼看不到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的_________ 进行系统性总结得出规律后进行推测;如今,科学家可以通过一种称之为__________________的仪器来测定分子的结构,该仪器的工作原理是利用分子中的原子不是固守不动的,而是不断地_______________着的,当一束____________透过分子时,分子会吸收跟它的某些化学键的__________相同的______________,再记录到图谱上呈现吸收峰,再通过计算机模拟,进行综合分析可知分子的立体结构。
5、填空题 硫化氢(H2S)分子中,两个H-S键的夹角接近90°,说明H2S分子的空间构型为_____________ ;二氧化碳(CO2)分子中,两个C=O键的夹角接近180°,说明CO2分子的空间构型为____________ ;甲烷(CH4)分子中,四个H-C键的夹角接近109°28′,说明CH4分子的空间构型为______________ 。