微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
参考答案:B
本题解析:
试题分析:A.铝片和镁片用导线连接后插入NaOH溶液中,由于Al能够与NaOH溶液发生反应,而Mg不能反应,所以尽管镁片较活泼,但是作正极,错误;B铝片和铜片用导线连接后插入浓硝酸中,由于Al在室温下在浓硝酸中会发生钝化,所以铜作负极,正确;C.镀锌铁和镀锡铁的镀层破损后,由于金属活动性Zn>Fe>Sn,所以对前者较易被腐蚀的是Zn,Fe就得到了保护,而后者较易被腐蚀的是Fe。所以镀层破损后,后者较易被腐蚀,错误;D.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用铁片作负极,Cu片或C棒作正极,FeCl3溶液作电解质,错误。
考点:考查原电池反应原理、组成、结构及应用的知识。
本题难度:一般
2、填空题 (14分)
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
|温度/ ℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)="0.003" mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(6)已知CO可用于制备很多物质:
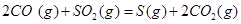 ΔH=+8.0kJ·mol-1 ΔH=+8.0kJ·mol-1
 ΔH=+90.4kJ·mol-1 ΔH=+90.4kJ·mol-1
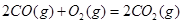 ΔH=-556.0kJ·mol-1 ΔH=-556.0kJ·mol-1
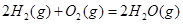 ΔH=-483.6kJ·mol-1 ΔH=-483.6kJ·mol-1
请写出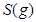 与 与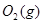 反应生成 反应生成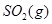 热化学方程式 。 热化学方程式 。
参考答案:(每空2分)
(1) <
本题解析:
试题分析:(1)由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0。
(2)反应初始6s内A的平均反应速率v(CO)=0.003mol?L-1?s-1,则6s内c(CO2)=△c(CO)=0.003mol?L-1?s-1×6s=0.018mol?L?1;CO的起始浓度=0.2mol/5L=0.04mol?L?1。
设平衡时A的浓度变化量为x,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故x?x/(0.04?x)(0.16?x) =1,解得x=0.032mol/L,所以平衡时A的转化率=0.032mol/L ÷0.04mol?L?1×100%=80%
(3)a、该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,错误;b、混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,错误;c、可逆反应到达平衡时,各组分的浓度不发生变化,故c(CO)不随时间改变,说明到达平衡,正确;d、单位时间里生成CO和H2的物质的量相等,正反应速率等于逆反应速率,说明到达平衡,正确。
(4)设CO、H2O的起始浓度分别为x、y,且CO的转化率为90%,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol?L-1) x y 0 0
转化浓度(mol?L-1) 0.9x 0.9x 0.9x 0.9x
平衡浓度(mol?L-1) 0.1x y-0.9x 0.9x 0.9x
K=0.9x?0.9x ÷[0.1x?(y?0.9x)] =0.6,得y/x=14.4,只要增加H2O量,就可提高CO的转化率。
(5)该电池中,正极反应一定是氧气得电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-)
(6)根据盖斯定律:S(g)+O2(g)=SO2(g)可由已知反应(③+④-①-②)/2得到,则S(g)与O2(g)反应生成SO2(g)热化学方程式为:S(g)+O2(g)=SO2(g)△H=-574.0kJmol-1。
考点:本题考查化学平衡判断及移动分析、化学反应速率、原电池原理、热化学方程式书写。
本题难度:一般
3、选择题 铁-镍蓄电池放电和充电时发生的反应为:
Fe + NiO2 +2H2O  Fe(OH)2 + Ni(OH)2?? Fe(OH)2 + Ni(OH)2??
关于此蓄电池的下列说法中不正确的是???????????????????????
A.放电时铁为负极
B.充电时阴极的电极反应式为:Ni(OH)2-2e- = NiO2 +2H+
C.放电时NiO2的反应为:NiO2 + 2H2O +2e- = Ni(OH)2 + 2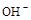
D.蓄电池的电极必须浸在碱性电解质溶液中
参考答案:B
本题解析:首先分析放电,为原电池,Fe失电子,发生氧化反应为负极;NiO2得电子,化合价降低,发生还原反应,故AC正确;充电为电解池,阴极还原反应,得电子,故B错误。生成物为氢氧化亚铁和氢氧化镍,故电解质溶液为碱性。
本题难度:一般
4、填空题 (14分)据图回答下列问题:
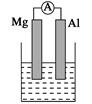
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ___________________
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技 术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为_______,
c口通入的物质为______。
②该电池负极的电极反应式为:_______
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,______________NA个电子转移。
参考答案:(14分)I(1)Mg逐渐溶解 Al
本题解析:
试题分析:I、(1)若烧杯中溶液为稀硫酸,则Mg与稀硫酸反应,所以Mg作负极,Al作正极,实验现象是Mg逐渐溶解、Al片上有气泡冒出、指针偏转;负极的反应式为Mg-2e-=Mg2+;
(2)若烧杯中溶液为氢氧化钠溶液,则Al与氢氧化钠反应,所以Al作负极,总反应即是Al与NaOH的反应,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
II、Al与浓硝酸发生钝化,所以Cu与浓硝酸反应,则Cu作负极,正极是NO3-发生还原反应生成二氧化氮,电极反应式为NO3-+e-+H+=NO2↑+H2O;
III、①根据图中氢离子的移动方向判断右侧是正极,左侧是负极,负极通入甲醇,所以b口通入的物质是CH3OH,正极通入的是空气或氧气,所以c口通入的是空气或氧气;
②负极发生氧化反应,根据图中所给信息,甲醇发生氧化反应后生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+;
③12.8 g甲醇完全转化为二氧化碳时,转移电子的物质的量是12.8g/32g/mol×6=2.4mol。
考点:考查原电池反应原理,正负极的判断、电极反应式的书写,氧化还原反应的计算
本题难度:一般
5、选择题 原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、NaCl溶液组成原电池,其负极反应式为:Cu - 2e-= Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗Cu电极32g
参考答案:C
本题解析:试题分析:A.由Al、Cu、稀H2SO4组成原电池,Al为负极,放电时SO42-向Al电极移动,A正确。B.由Mg、Al、NaOH溶液组成原电池,Al为负极失电子氧化反应:Al-3e-+4OH-=AlO2-+2H2O,B正确。C.由Fe、Cu、NaCl溶液组成原电池,Fe为负极,负极反应式为:Fe-2e-=Fe 2+,C不正确。D.由Al、Cu、浓硝酸组成原电池中铝钝化作正极,铜作负极电极反应为Cu-2e-=Cu 2+;电解硝酸银溶液,当析出1 mol Ag时,电路中转移1 mol电子,消耗Cu 0.5mol为32g,D正确。
考点:了解原电池、电解池工作原理,能写出电极反应和电池反应方程式,会进行简单计算。
点评:原电池中电极的判断不仅与电极材料的性质有关如活泼性、是否发生钝化等,也与电解质溶液有关如酸溶液、碱溶液、强氧化性溶液等;复杂电路中的有关计算常利用电子守恒的思想解决。
本题难度:一般
|