微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (4分)实验室利用右图所示装置进行Na2CO3和NaHCO3热稳定性对比实验。请回答:
(1)加热一段时间后,两试管中石灰水的变化是???。
A.均变浑浊
B.试管1澄清,试管2变浑浊
C.试管2澄清,试管1变浑浊
(2)该实验说明二者中 91exam.org热稳定性强的物质是???(填化学式),另一种物质受热分解的化学方程式是????????????????????????????????????????。
参考答案:(1)C? (1分)
(2)Na2CO3 ????2
本题解析:考查钠的碳酸盐的性质
Na2CO3热稳定性好,加热不分解,但NaHCO3热稳定性差,在较低温度下即可分解:2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
因此为了更好的比较两者的热稳定性的差异,应将Na2CO3置于大试管中,直接加热,而NaHCO3置于小试管内,间接加热
实验现象:试管2澄清,试
本题难度:一般
2、选择题 取一小块钠在坩埚中加热,看到的现象依次是 (???)
①在空气中燃烧,火焰为黄色 ???②燃烧得到白色固体
③金属钠熔化 ?????????????????④产物是浅黄色的固体物质
A.①②③
B.①②④
C.③①④
D.②③④
参考答案:C
本题解析:
试题分析:钠受热先熔化,而后燃烧,火焰为黄色,产物是浅黄色的过氧化钠。金属钠在空气中被氧化,产物为白色的氧化钠。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。
本题难度:简单
3、选择题 把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A.3.18g
B.2.12g
C.4.22g
D.5.28g
参考答案:A
本题解析:
试题分析:溶液中钠离子的物质的量=0.1L×0.6mol/L=0.06mol。固体混合物加热最终的生成物是碳酸钠,因此根据钠离子守恒可知,碳酸钠的物质的量=0.06mol÷2=0.03mol,则残留物的质量=0.03mol×106g/mol=3.18g,答案选A。
本题难度:一般
4、选择题 试管A中含有10mL0.6mol/L Na2CO3溶液,试管B中含有10 mL0.8mol/L HCl溶液,现将试管A逐渐倒入试管B中产生气体的体积与将试管B逐渐倒入试管A中产生气体的体积比为
A.4:l
B.5:3
C.3:1
D.2:1.
参考答案:D
本题解析:此题涉及过量问题,通过计算,Na2CO3=0.006mol,HCl=0.008mol.将A管中Na2CO3滴入B管里的HCl,马上就能产生气体,直到将HCl中的H+消耗干净,离子方程式为CO32-+2H+=H2O+CO2↑通过物质的量关系可以看出CO32-过量,产生气体物质的量为0.004mol.若将B管中液体滴入A管,则先有离子反应H++CO32-=HCO3-,H+过量,生成0.006molHCO3-剩余0.002molH+,继续滴加HCl,又有离子反应H++HCO3-=H2O+CO2↑.相对于0.00
本题难度:一般
5、选择题 钠在干燥的空气中形成的氧化物0.7 g,溶于水后,可被0.25 mol·L-1的盐酸80 mL恰好中和,则钠的氧化物的成分是( )?
A.Na2O
B.Na2O与Na2O2?
C.Na2O2
D.Na2O与NaO2?
参考答案:B?
本题解析:因加入盐酸后恰好中和,由NaCl的组成知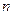 ?(Na+)=
?(Na+)= 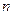 ?(Cl-)="0.02" mol,所以氧化物中
?(Cl-)="0.02" mol,所以氧化物中![]()
本题难度:简单