微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把ag Na2O和a1 g Na2O2分别加入等质量的水中(水足量),结果得到同浓度的溶液,则a和a1的关系正确的是(???)
A.a=a1
B.a>a1
C.a<a1
D.无法判断
参考答案:C
本题解析:Na2O+H2O2NaOH,2Na2O2+2H2O====4NaOH+O2↑,由于Na2O2溶于水中,部分水将参加反应,放出氧气,所以欲想将它们溶于等质量的水时形成等浓度的溶液,必须使m(Na2O)<m(Na2O2)。
本题难度:简单
2、选择题 在泡沫灭火器中放NaHCO3而不用Na2CO3,下列解释不合理的是
A.与酸反应时,NaHCO3放出CO2的速度更快
B.NaHCO3受热较易分解
C.等质量NaHCO3与Na2CO3,前者产生CO2气体多
D.NaHCO3比Na2CO3昂贵
参考答案:B
本题解析:本题考查应用化学知识解释实际化学问题的能力。泡沫灭火器中所以用NaHCO3而不用Na2CO3,应从灭火效力上考虑,即NaHCO3灭火效力大。在同样条件下,NaHCO3与H+反应产生CO2的速度比NaCO3的速度快,更有利于快速灭火。1mLNaHCO3和Na2CO3都产生1mol CO2,但前者为84g,后者为106g,所以在盛重一定的灭火器内,装NaHCO3比装Na2CO3产生的CO2多,也有利于灭火。所以A,C的解释是正确的。显然B不是合理的解释。
本题难度:一般
3、选择题 将2. 3g钠放入100g水中,所得溶液的质量分数是(???)
A.等于2.3%
B.等于4%
C.大于2.3%小于4%
D.大于4%
参考答案:C
本题解析:
试题分析:2.3g金属钠的物质的量是2.3g÷23g/mol=0.1mol
2?Na+2H2O=2NaOH+H2↑
2mol?????? 2mol? 1mol
0.1mol????? 0.1mol 0.05mol
即反应后溶质氢氧化钠的质量是0.1mol×40g/mol=4g
溶液的质量是2.3g+100g-0.05mol×2g/mol=102.2g
则氢氧化钠的质量分数是 本题难度:一般
本题难度:一般
4、填空题 (8分)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠的化学式是?????????,俗称???????,其水溶液显????性(填“酸”、“碱”或“中”), 在焰色反应中呈______色。碳酸钠的俗称_________。
(2)等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应生成CO2的量,前者?????后者(填>、<或=)。写出与盐酸反应的离子方程式????????????????????????????
(3)写出碳酸氢钠受热分解的化学方程式:???????????????????????????
参考答案:(1)NaHCO3??小苏打??碱??苏打或者纯碱 (2)C
本题解析:
试题分析:(1)碳酸氢钠:化学式为NaHCO3,俗称小苏打,其水溶液由于碳酸根离子要发生水解,使得溶液呈碱性。碳酸钠的俗称苏打或者纯碱。
(2)NaHCO3与HCl反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;Na2CO3与HCl反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;由以上两个化学方程式可以看出,等物质的量的Na2CO3和NaHCO3分别与HCl反应,产生CO2的物质的量之比为1:1。
(3)碳酸氢钠受热分解产物为:碳酸钠、水
本题难度:一般
5、实验题 化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
【方案一】 称取一定质量的固体样品,通过加热至恒重后冷却,称量剩余固体质量,计算。
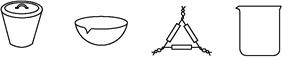
(1)下列仪器中,在灼烧固体样品时必须用到的是 (填名称)。?
(2)实验中需加热至恒重的目的是: ??????????????????????????????????????。
(3)实验中确定加热至恒重的方法是: ??????????????????????????????????????。
(4)若加热过程中有晶体迸溅出来,则测得的结果 (填“偏大”、“偏小”或“不变”)。
【方案二】 称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(已知:Ba2++OH-+HC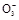
 BaCO3↓+H2O)
BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为???????????????????? 。
(2)实验中判断沉淀是否完全的方法是 ???????????????????????????????。
(3)实验中洗涤沉淀的操作是 ?????????????????????????????????????????????。
(4)实验中判断沉淀是否洗涤干净的方法是 ??????????????????????????????????。
【方案三】 按如图所示装置进行实验:
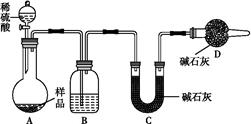
(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 ?????????????。
参考答案:【方案一】 (1)坩埚、泥三角
(2)保证NaHCO3
本题解析:【方案一】 小苏打受热分解,根据反应前后固体质量的变化,可以测定小苏打样品中Na2CO3的质量分数。(1)给固体灼烧需用到的仪器有:酒精灯、三脚架、坩埚、泥三角、坩埚钳。(2)加热至恒重的目的是保证NaHCO3分解完全。(3)当两次称量剩余固体的质量差不超过0.1 g时,说明已经加热至恒重。(4)加热过程中迸溅出晶体时,最后剩余的固体质量减小,求出的小苏打的质量增大,进而求出的苏打的质量减小。
【方案二】 (1)过滤操作中用到的仪器有:铁架台(附铁圈)、烧杯、漏斗、玻璃棒、滤纸。(2)判断沉淀是否完
本题难度:困难