微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 当一个化学反应中反应物总能量大于生成物总能量时,此反应为_______反应(吸热或放热),酸碱中和是____________反应(吸热或放热)。
参考答案:发热???发热
本题解析:考查化学反应中的能量。化学变化的特征之一是伴随能量的变化,如果反应物的总能量高于生成物的总能量,就是放热反应,反之是吸热反应。中和反应属于放热反应。
本题难度:简单
2、填空题 能源是人类生存和发展的重要支柱。研究和有效地开发新能源在能源紧缺的今天具有重要的理论意义。
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g)?ΔH=-241.8 kJ/mol??
② C(s)+1/2O2(g) =CO(g)?ΔH=-110.5 kJ/moL?
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g)?ΔH=??????kJ/moL
(2)研究活化能对于能源技术的革新有非常重大的实际意义。请认真观察下图,回答问题:
① 图中反应的ΔH=????????????kJ/mol(用含有E1、E2代数式表示)。
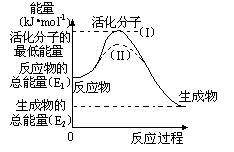
② 已知热化学 方程式:H2(g)+1/2O2(g) =?H2O(g)?ΔH=-
方程式:H2(g)+1/2O2(g) =?H2O(g)?ΔH=- 241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为????????kJ/mol。
241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为????????kJ/mol。
③ 图中虚线(II)与实线(I) 对于同一反应具有的意义:
?????????????????????????????????????????????????????????????????????。
参考答案:(1)+131.3
(2)① —(E1- E2)或(E
本题解析:略
本题难度:简单
3、简答题 (2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5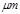 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
离子
| H+
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol·L-1
| 未测定
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
?
根据表中数据判断试样的pH=?????????。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g)???????△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:????????????? ?????????????????。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是???????????。
A.Ca(OH) 2?? B.Na2CO3? C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g)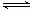 2NO(g)?△H 2NO(g)?△H 0 0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K=???????????????。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是???????????。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为???????? ????????????????????。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H 0,判断该设想能否实现并简述其依据:???????????????????。 0,判断该设想能否实现并简述其依据:???????????????????。
参考答案:(1)PH=4
(2)①C(s)+H2O(g)=H2(
本题解析:
(1)根据溶液呈电中性的原理可得c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)。将各个数值代入上述式子可得c(H+)=1.0×10-4mol/L,所以pH=4;(2)①?②-①整理可得C(s)+H2O(g)=H2(g)+CO(g)?△H=+131.3kJ/mol;②A.Ca(OH) 2+ SO2=CaSO3↓+H2O;正确。B.Na2CO3+ SO2=Na2SO3+ CO2。正确。C.CaCl2不反应,不能作吸收剂,错误。D.NaHSO3不反
本题难度:一般
4、选择题 对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l);△H =-5800kJ/mol的叙述错误的是
A.该反应的反应热为△H=-5800kJ/mol,是放热反应
B.该反应的△H与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol
参考答案:D
本题解析:
试题分析:燃烧热是指完全燃烧1mol可燃物的时候所放出的热量,由此可知丁烷的燃烧热为2900kJ/mol,因此,D错误。
本题难度:一般
5、选择题 分析下面的能量变化示意图,确定下列热化学方程式正确的是(????)

A.2A(g)+B(g)=2C(g);△H<0
B.2A(g)+B(g)=2C(g);△H>0
C.2A+B=2C;△H<0
D.2C=2A+B;△H<0
参考答案:A
本题解析:根据图像可知,2molA和1molB的总能量高于2molC的总能量,即2molA和1molB生成2molC的反应是放热反应,所以选项A正确,B不正确。CD都没有注明状态,不正确,答案选A
本题难度:一般
|