微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.已知H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应、稀醋酸与稀NaOH溶液反应所测得的中和热都为ΔH=-57.3kJ/mol
B.由C(石墨,s)= C(金刚石,s)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定
C.在用标准盐酸滴定未知浓度氢氧化钠溶液的实验中,若用待测液润洗锥形瓶,则测定结果偏低(其他操作正确)
D.向存在着FeCl3 (黄色)+3KSCN 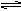 Fe(SCN) 3(血红色) +3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化
Fe(SCN) 3(血红色) +3KCl平衡体系的溶液中,加少量KCl固体,溶液血红色不发生变化
参考答案:D
本题解析:
试题分析:中和热不包含离子在溶液中的生热,溶质的溶解热和电解质电离吸收热等伴随的热效应,浓硫酸溶解放热,稀醋酸电离吸热,故所测中和热均不该是ΔH=-57.3kJ/mol,故A错;通过热化学方程式可以看出,反应为吸热反应,石墨的能量低,则石墨比金刚石稳定,故B错误;在滴定实验中,用待测液润洗锥形瓶,只会导致结果偏大,故C错误;铁离子的检验非常敏锐,Fe(SCN) 3浓度变化不足以引起红色的变化,故D正确。
考点:考查中和热和化学平衡相关知识
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.在硅酸钠溶液中通入过量的二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32-
B.向澄清石灰水中滴加过量碳酸氢钠溶液Ca2++HCO3-+OH-═CaCO3↓+H2O
C.铜跟浓硝酸反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.在硫酸氢钠溶液中加入等物质的量的氢氧化钡溶液H++SO42-+Ba2++OH-=BaSO4↓+H2O
参考答案:D
本题解析:分析:A、二氧化碳过量生成碳酸氢钠;
B、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式的组成比;
C、铜和浓硝酸反应生成二氧化氮气体;
D、按照等物质的量混合分析反应的离子.
解答:A、在硅酸钠溶液中通入过量的二氧化碳:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故A错误;
B、向澄清石灰水中滴加过量碳酸氢钠溶液的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-;故B错误;
C、铜跟浓硝酸反应生成二氧化氮气体,Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故C错误;
D、在硫酸氢钠溶液中加入等物质的量的氢氧化钡溶液反应的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O,故D正确;
故选D.
点评:本题考查了离子方程式的书写方法和正误判断,主要考查量不同产物不同,反应生成的物质判断.
本题难度:困难
3、选择题 下列各分子中,化学键类型不同的是
A.H2O、CO2
B.MgF2、H2O2
C.KOH、Mg(OH)2
D.HCl、HBr
参考答案:B
本题解析:
试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,据此可知,A中都是极性键,B中前者是离子键,后者是共价键,C中都含有离子键和极性键,D中都是极性键,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查。难度不大,主要是考查学生对化学键知识的了解掌握程度。该题的关键是明确离子键和共价键的含义以及判断依据,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 下列说法正确的是
A.化学键断裂的过程是吸收能量的过程
B.水分解产生氢气和氧气时放出能量
C.需要加热的反应就是吸热反应
D.并不是所有的化学反应都伴随着能量变化
参考答案:A
本题解析:
试题分析:A.化学反应的实质是既包括化学键断裂的过程,又包括化学键形成的过程,断裂化学键吸收能量,形成化学键释放能量,正确;B.水分解产生氢气和氧气时吸收能量,错误;C.反应条件与反应放热与否没有关系,错误; D.所有的化学反应都伴随着能量变化,错误;选A。
考点:考查化学反应中能量变化的原因。
本题难度:一般
5、选择题 下列图示关系不正确的是( )
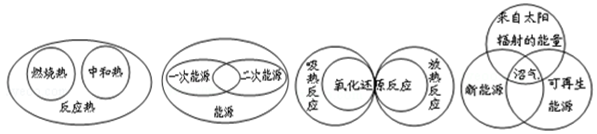
A B C D
参考答案:B
本题解析:
试题分析:A、中和热和燃烧热都属于反应热,正确;B、能源包括一次能源和二次能源,二者不重合,错误;C、氧化还原反应可以是吸热反应,也可以是放热反应,吸热反应、放热反应不一定是氧化还原反应,正确;D、沼气是一种新能源,利用太阳辐射的能量,属于可再生能源,正确。
考点:考查反应热与燃烧热、中和热的关系,能源的分类,氧化还原反应与吸热放热反应的关系。
本题难度:一般