微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨。标准状况下生成二氧化碳的体积为______________L,石灰石中碳酸钙的质量分数为______________%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为________________________。
(3)第③步反应一般不采用通入CO2的主要原因是______________________,
相应的离子方程式为_____________________________________。
(4)CaCO3是一种难溶物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4 mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______________。
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:
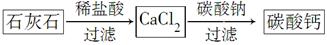
与前一方案相比较,该方案的优点是_________________________________。
参考答案:(1)2.24×107 90.9
(2)CaSiO3<
本题解析:(1)根据质量差生成CO2 44吨,物质的量为1×106 mol,体积为2.24×107 L,对应CaCO3为100吨质量分数为90.9%。
(2)SiO2与生成的CaO反应生成CaSiO3。
(3)通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解
CaCO3+CO2+H2O=Ca2++2HCO3-。
(4)Ksp=2.8×10-9=[ Ca2+][CO32-]=2.0×10-4×0.5×x×0.5,x=5.6×10-5 mol/L。
(5)不需要加热,操作简单
本题难度:一般
2、选择题 常温下,在100mL 0.01mol?L-1KCl溶液中,加入1mL 0.01mol?L-1AgNO3溶液,下列说法正确的是(AgCl的Ksp=1.8×10-10mol2?L-2)( )
A.有AgCl沉淀析出
B.无AgCl沉淀
C.无法确定
D.有沉淀但不是AgCl
参考答案:由AgCl(s)?Ag++Cl-,Ksp=c(Ag+).c(
本题解析:
本题难度:一般
3、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液
中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是??????????? ( ??? )
A.25℃时,0.1 mol·L-1 HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
参考答案:D
本题解析:
试题分析:现向lL0.2 mol·L-1HF溶液中加入1L0.2 mol·L-1CaCl2溶液,则此时c(F-)×c(H+)/c(HF)=3.6×10-4,所以c(F-)=c(H+)=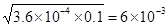 mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1
mol/L。由于c(Ca2+)=0.1mol·L-1,则此时c(F-)×c(F-)×c(Ca2+)=3.6×10-6>1
本题难度:简单
4、选择题 常温下KSp(AgCl)=1.8×10-10, KSp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法不正确的是( )
A 两清液混合,AgCl和AgI都沉淀
B 向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
C若AgNO3足量, AgCl和AgI都可沉淀,但以AgCl为主
D若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
参考答案:
D.
本题解析:
AgCl饱和溶液中c(Ag+)= c(Cl-)=(1.8×10-10)1/2=1.3×10-5mol/L,AgI的饱和溶液中c(Ag+)= c(I-)=(1×10-16)1/2=1×10-8mol/L,等体积混合后c(Ag+)=(1.3×10-5+1×10-8)/2,c(Cl-)=1.3×10-5/2, c(I-)=1×10-8/2,此时c(Ag+)·c(Cl-)<KSp(AgCl),c(Ag+)· c(I-)>KSp(AgI),所以无AgCl沉淀有AgI沉淀,A错。向AgI清液加入AgNO3,c
本题难度:一般
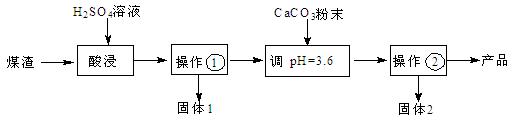
5、简答题 (16分)某煤渣主要含有Al2O3、SiO2,可制备碱式硫酸铝[Al2(SO4)3·2Al(OH)3]溶液,用于烟气脱硫,减少SO2的排放,其制备流程:
已知:25℃,Ksp(CaCO3)=2.8×10-9, Ksp(CaSO4)=9.1×10-6。
(1)操作①的名称 。
(2)酸浸时反应的离子方程式为 ;为了提高酸浸时铝元素的浸出率,可采取的措施____________________,___________________(写2条)。
(3)固体2的化学式是 ,试分析固体2生成的主要原因(用离子方程式结合文字简要说明) 。
(4)碱式硫酸铝溶液吸收SO2生成Al2(SO4)3·Al2(SO3)3,再向该溶液通入足量空气,生成一种硫酸盐,用于制备碱式硫酸铝溶液的循环使用,试写出有关反应的化学方程式: , 。
参考答案:(1)过滤(2分)
(2)Al2O3 + 6H+= 2
本题解析:
试题分析:煤渣主要含有Al2O3、SiO2,煤渣和稀硫酸混合,发生反应Al2O3+3H2SO4
本题难度:困难