微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,在容积固定不变的密闭容器中发生下列可逆反应:
2X(g) + Y(g) 2Z(g)?△H =-Q kJ/mol平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,放出热量Q kJ,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
2Z(g)?△H =-Q kJ/mol平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,放出热量Q kJ,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
A.原平衡时,X的转化率为50%
B.达到新平衡时,X的转化率不变
C.达到新平衡时,容器内气体的平均相对分子质量增大
D.达到新平衡时,平衡常数K增大
参考答案:C
本题解析:略
本题难度:简单
2、填空题 t℃时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:
3A(g) + B(g)  ?xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
?xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡的状态,生成C平均反应速率为?????????.
(2)x=?????????;平衡常数K=???????????.
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母)?????????;A、向正反应方向移动?? B、向逆反应方向移动????? C、平衡不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新平衡,此时B的物质的量为
n(B)=???????mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为:?????????。
参考答案:(1)0.2mol/(L·min) (2) 4?? 1/27
本题解析:
试题分析:(1)C的浓度为0.4mol/L,则生成C的反应速率是0.4mol/L÷2min=0.2mol/(L·min)。
(2)消耗B的物质的量是0.2mol,其浓度是0.1mol/L,则根据浓度的变化量之比是相应的化学计量数之比可知,x=4。平衡时剩余A的物质的量是3mol-0.6mol=2.4mol,其浓度是1.2mol/L,所以平衡常数K=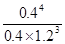 =
=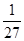 。
。
(3)氦气不参与反应,所以平衡不移动,答案选C。
(4)由于反应前后体积不变,则向原平衡混合物的容器中再充入amolC,则平衡是等效的,所以在t℃时达到新平衡,此时B的物质的量为 。
。
(5)由于反应前后体积不变,则等效平衡的条件是等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。所以三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为n(A)/n(B) =3/1,n(C)≥0。
点评:该题是中等难度的试题,试题综合性强,对学生的思维能力提出了更高的要求。试题在侧重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确平衡常数和等效平衡的含义以及影响因素,然后依据方程式灵活运用即可。有利于培养学生的逻辑推理能力,提高学生分析、归纳、总结问题的能力。
本题难度:一般
3、选择题 一定温度下,在固定体积的密闭容器中进行反应:N2+3H2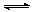 2NH3。该反应达到平衡的标志是
2NH3。该反应达到平衡的标志是
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时生成3m mol H2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
参考答案:D
本题解析:略
本题难度:一般
4、选择题 某温度时,在2L容器中三种物质的物质的量随时间的变化曲线如下图所示。 由图中数据分析,该反应的化学方程式和反应开始至2min末Z的平均反应速率分别为
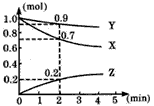 [???? ]
[???? ]
A. 3X+Y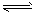 2Z; 0.05mol·L-1·min-1
2Z; 0.05mol·L-1·min-1
B. 2X+Y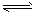 2Z; 0.1mol·L-1·min-1
2Z; 0.1mol·L-1·min-1
C. X+2Y ==Z;0.1mol·L-1·min-1
D. X+3Y==2Z;0.05mol·L-1·min-1
参考答案:A
本题解析:
本题难度:一般
5、计算题 (12分)在一定温度下,向容积不变的容器中加入2 mol N2、8 mol H2及固体催化剂,使之反应。已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ· mol-1。平衡时,容器内气体压强为起始时的80%。
(1)反应达到平衡时,放出的热量 ( ? )
A.小于92.2 kJ ??????????? B.等于92.2 kJ ??????????? C.大于92.2 kJ
(2)保持同一温度,在相同的容器中,若起始时加入2 mol NH3、1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数????????????????????????????? ( ? )
A.等于0.25 ???????????? B.大于0.25 ??????????? C.小于0.25
(3)保持同一温度,在相同的容器中,起始通入一定物质的量N2、H2、NH3,欲使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则充入N2的物质的量a mol的取值范围是_________________________________________。
(4)如图是T1℃时容器中NH3的物质的量随时间的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时n(NH3)的变化曲线。
参考答案:(12分)? (1)B ? 3分?? (2)C???? 3分
本题解析:(1)????? N2(g)+3H2(g)  2NH3(g)
2NH3(g)
起始量(mol)???? 2?????? 8????????? 0
转化量(mol)???? x????? 3x????????? 2x
平衡量(mol)?? 2-x??? 8-3x???????2x
所以有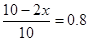 ,解得x=1,所以生成氨气是2mol,则发出热量是92.2 kJ,答案选B。
,解得x=1,所以生成氨气是2mol,则发出热量是92.2 kJ,答案选B。
(2)2 mol NH3、1 mol H2相当于是2mol、4mol氢气。由于反应是体积减小的可逆反应,所以产生相当于在用来的基础上减压,平衡向逆反应方向移动,所以氨气的分数小于0.25,答案选C。
(3)根据(1)可知,平衡时氮气是1mol,所以要使平衡时NH3的体积分数一定等于0.25。且起始时向正反应方向进行,则氮气的物质的量不需满足1<a≤2。
(4)温度高,反应速率快,达到平衡的时间少。但平衡向逆反应方向移动,所以图像为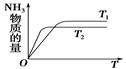 。
。
本题难度:一般