微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (18分)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
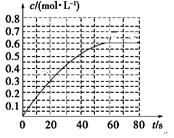
①298k时,该反应的平衡常数为________ L ·mol-1。
②下列事实能判断该反应处于平衡状态的是?????
a.混合气体的密度保持不变?
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol? n(N2O4)=1.2mol,则此时
V(正)???V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
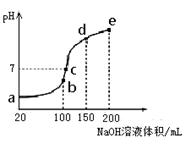
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常??????
数K数值的是????;
③在c点,溶液中各离子浓度由大到小的排列顺序
是__________。
参考答案:(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+
本题解析:
试题分析:(1)根据题给信息和热化学方程式的书写原则知,室温下液态偏二甲肼和液态四氧化二氮反应的热化学方程式C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l)? ΔH=-2550?kJ·mol-1。(2)①根据题给图像知,298k时,N2O4的平衡浓度为0.6mol/L,N2O4的浓度为NO2的2倍,NO2的平衡浓度为0.3mol/L,该反应的平衡常数K=[N2O4]/[NO2]2=0.6/0.32="6.67" L ·mol-1。② a.反应在容积不变的容器中进行,由质量守恒定律知,混合气体的质量不变,混合气体的密度不随反应的进行而变化,不能作为平衡标志,错误; b.混合气体的颜色是由二氧化氮引起,混合气体的颜色不再变化,二氧化氮的浓度不变,已达平衡,正确; c. 由V(N2O4)正=2V(NO2)逆知,V(N2O4)正:V(NO2)逆=2,不等于化学计量数之比,错误,选b;③反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0)为放热反应,升高温度,平衡逆向移动,平衡常数减小,若反应在398K进行,平衡常数K<6.67 L ·mol-1,某时刻测得n(NO2)="0.6" mol? n(N2O4)=1.2mol,则此时Q=c(N2O4)/c2(NO2)="6.67" L ·mol-1,Q>K,反应逆向进行,V(正)<V(逆)。(3)向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,发生的反应依次为:H++OH-
N2O4(g) ΔH=-a kJ·mol-1 (a>0)为放热反应,升高温度,平衡逆向移动,平衡常数减小,若反应在398K进行,平衡常数K<6.67 L ·mol-1,某时刻测得n(NO2)="0.6" mol? n(N2O4)=1.2mol,则此时Q=c(N2O4)/c2(NO2)="6.67" L ·mol-1,Q>K,反应逆向进行,V(正)<V(逆)。(3)向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,发生的反应依次为:H++OH- H2O、NH4+ + OH-
H2O、NH4+ + OH- NH3·H2O。①当氢离子恰好完全反应时,溶液为硫酸钠和硫酸铵的混合物,水的电离程度最大,结合图像知,水的电离程度最大的是b;②Kb(NH3·H2O)=c(NH4+)c(OH-)/c(NH3·H2O),c(NH4+)与c(NH3·H2O)相等时,其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值,结合题给图像知是d;③由图像知,c点溶液呈中性,溶液为硫酸钠、硫酸铵和一水合氨的混合液,各离子浓度由大到小的排列顺序是c(Na+)>c(SO
NH3·H2O。①当氢离子恰好完全反应时,溶液为硫酸钠和硫酸铵的混合物,水的电离程度最大,结合图像知,水的电离程度最大的是b;②Kb(NH3·H2O)=c(NH4+)c(OH-)/c(NH3·H2O),c(NH4+)与c(NH3·H2O)相等时,其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值,结合题给图像知是d;③由图像知,c点溶液呈中性,溶液为硫酸钠、硫酸铵和一水合氨的混合液,各离子浓度由大到小的排列顺序是c(Na+)>c(SO )>c(NH4+)>c(OH-)=c(H+)。
)>c(NH4+)>c(OH-)=c(H+)。
本题难度:一般
2、简答题 SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)?2SO3(g)△H<0.若向一个2L的密闭容器中充入0.4mol?SO2、0.2mol?O2和0.4mol?SO3发生上述反应.
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为______.
(3)某温度时,将4mol?SO2和2mol?O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=______,该温度下反应2SO2(g)+O2(g)?2S03(g)的平衡常数K=______.
参考答案:(1)SO2、O2、SO3起始浓度分别为0.2mol/L、0
本题解析:
本题难度:一般
3、填空题 (8分)如下图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时A、B的体积均为a L,在相同温度和有催化剂条件下,两容器中各自发生反应:
X(g)+Y(g) ?2Z(g)+W(g)(正反应为放热反应)达到平衡时A容器的体积为1.2a L。
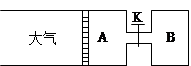
(1)? A中X的转化率αA=????????
(2)? A、B中X的转化率αA ??????αB(填 >、< 或 = )
(3)?打开K,一段时间又达到平衡时A的体积为?????L(连通管中气体体积忽略不计)
(4)?在(3)达到平衡后,同时等幅升高A、B的温度,达到新平衡后,A的体积?????(填变大、变小或不变)
参考答案:(1)40%(2)>?(3)2.6a L?(4)变小
本题解析:(1)????????????????X(g)+Y(g) ?2Z(g)+W(g)
起始量(mol)?????????????????1???? 1?????? 0????? 0
转化量(mol)????????????????x???? x?????? 2x?????? x
平衡量(mol)???????????????1-x?? 1-x????? 2x???? x
因为体积之比是物质的量之比
所以
解得x=0.4
即转化率是40%
(2)A保持恒压,B保持恒容。正反应是体积增大的反应,压强大转化率低。在反应过程中B中的压强大于A中的。所以A中的转化率大于B中的转化率。
(3)打开之后相当于保持恒压,因此平衡和A是等效的,即转化率是相同的。则平衡时的总体积是1.2aL×3=3.6aL,所以A的体积为3.6aL-aL=2.6aL。
(4)反应是放热反应,升高温度,平衡向逆反应方向移动,体积减小。
本题难度:一般
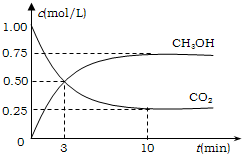
4、填空题 降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L?min);
②氢气的转化率=______;
③该反应的平衡常数为______(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1molCO2和3molH2.
参考答案:(1)①利用三段式解题法计算
CO2(g)+3H2
本题解析:
本题难度:一般
5、选择题 室温下,等体积的NO和O2混合,混合气体的平均相对分子质量是[???? ]
A.31
B.41.3
C.稍大于41.3
D.稍小于41.3
参考答案:C
本题解析:
本题难度:一般