微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列解释事实的方程式不正确的是
A.向NaHCO3溶液中加入NaOH溶液:HCO3-+ OH- CO2↑ + H2O
CO2↑ + H2O
B.盛放烧碱的试剂瓶不能用玻璃塞:SiO2 + 2NaOH Na2SiO3 + H2O
Na2SiO3 + H2O
C.为减少煤燃烧产生SO2,用CaCO3脱硫:2CaCO3 + O2 + 2SO2 2CaSO4 + 2CO2
2CaSO4 + 2CO2
D.向AgCl悬浊液中加入Na2S溶液:2AgCl + S2- Ag2S + 2Cl-
Ag2S + 2Cl-
参考答案:A
本题解析:
试题分析:A、向NaHCO3溶液中加入NaOH溶液应为:HCO3-+ OH- CO32—+ H2O,错误;B、盛放烧碱的试剂瓶不能用玻璃塞:SiO2 + 2NaOH
CO32—+ H2O,错误;B、盛放烧碱的试剂瓶不能用玻璃塞:SiO2 + 2NaOH Na2SiO3 + H2O,正确;C、为减少煤燃烧产生SO2,用CaCO3脱硫:2CaCO3 + O2 + 2SO2
Na2SiO3 + H2O,正确;C、为减少煤燃烧产生SO2,用CaCO3脱硫:2CaCO3 + O2 + 2SO2 2CaSO4 + 2 CO2,正确;D、向AgCl悬浊液中加入Na2S溶液:2AgCl + S2-
2CaSO4 + 2 CO2,正确;D、向AgCl悬浊液中加入Na2S溶液:2AgCl + S2- Ag2S + 2Cl-,正确。
Ag2S + 2Cl-,正确。
考点:考查化学方程式、离子方程式正误判断。
本题难度:一般
2、选择题 可以用离子方程式H++OH-=H2O表示的化学反应是
①稀硫酸与氢氧化钡溶液反应 ②氢氧化钾溶液与稀硝酸反应
③稀盐酸与氢氧化铜反应 ④澄清石灰水与盐酸反应
A.①③
B.②④
C.①②④
D.②③④
参考答案:B
本题解析:
试题分析:①中还有难溶性硫酸钡沉淀生成,应该用化学式表示,不符合题意;③中的氢氧化铜是难溶性物质,应该用化学式表示,不符合题意,所以正确的答案选B。
考点:考查离子方程式的有关判断
点评:该题主要是考查学生对离子方程式意义、表示以及判断的了解掌握情况,意在培养学生分析、归纳和总结问题的能力,有利于培养学生的逻辑推理能力和逆向思维能力。
本题难度:一般
3、填空题 (10分)元素周期表中第三周期元素的单质及其化合物的用途广泛。
(1)该周期元素中,半径最小的简单离子的离子结构示意图为 。
(2)能证明氯的非金属性(得电子能力)比硫强的化学方程式为 。
(3)NaHSO3溶液呈酸性,其溶液中离子浓度由大到小的顺序为 。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为 。
(5)已知下列两反应过程中能量变化如图所示:
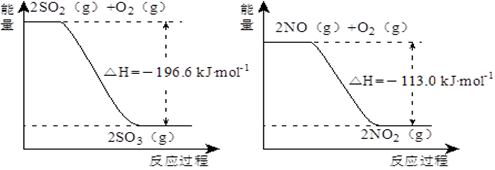
汽车尾气中含有的少量NO2和SO2在一定条件下会发生反应,该反应的热化学方程式为____________。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)在第三周期元素中,半径最小的简单离子是铝离子,其离子结构示意图为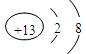 。
。
(2)非金属性强元素单质能置换出非金属性弱的单质,则能证明氯的非金属性(得电子能力)比硫强的化学方程式为Cl2 + H2S = S↓ + 2HCl。
(3)NaHSO3溶液中电离程度大于水解程度,因此溶液呈酸性,所以其溶液中离子浓度由大到小的顺序为[Na+]>[HSO3-]>[H+]>[ SO32-]>[OH-]。
(4)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,则根据电子得失守恒以及质量守恒定律可知该反应的离子方程式为2 ClO2 + 5Mn2+ + 6H2O = 5MnO2 ↓+ 2Cl- + 12H+。
(5)根据图像可知反应的热化学方程式为① O2(g) +2SO2(g) =2SO3(g) △ H =-196.6kJ·mol-1、②2NO(g) + O2(g) =2NO2(g) △ H = -113.kJ·mol-1,则根据盖斯定律可知(①-②)÷2即得到NO2(g) + SO2(g) =" NO(g)" + SO3(g) △ H = -41.8kJ·mol-1。
考点:考查元素周期律的应用以及热化学方程式书写等
本题难度:一般
4、填空题 (1)下列操作错误的是_________(填序号)
A. 用蒸发皿进行加热蒸发实验时,不垫石棉网。
B. 浓硫酸不慎沾到皮肤上,迅速用NaOH溶液清洗,再用水洗。
C. 闻气体气味时,用手在容器口轻轻扇动,使少量气体飘入鼻孔中。
D. 使用分液漏斗和容量瓶时,首先检查是否漏液。
E.做实验时,剩余试剂一律不能放回原试剂瓶。
(2) 最近媒体报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(有效成分是NaClO)发生氯气中毒的事件。根据你所学的氧化还原反应知识,用离子方程式表示产生氯气的原因: 。
(3) 已知向四羟基铝酸钠溶液中加入稀盐酸有氢氧化铝生成。某同学根据所学知识,提出不能使用该方法制取A1(OH)3,理由为 。(用离子方程式表示)
请你另举出一种用氯化铝溶液制取A1(OH)3的合理方法,该反应的离子方程式为 。
(4)据有关报道。目前已能冶炼出纯度高达99.9999%的铁,下列关于纯铁的叙述中,正确的是 (填字母)。
A.硬度比钢小,熔点比钢高 B.不能与盐酸反应
C.与不锈钢成分相同 D.在冷的浓硫酸中钝化
(5)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色时停止加热,所得分散系的分散质大小范围是 。
(6)合成氨工业生产中常用铁触媒做催化剂,其主要成分是FeO、Fe2O3。已知某铁触媒中,铁、氧离子的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为 。
参考答案:(1) BE
本题解析:
试题分析:(1)中,浓硫酸不慎沾到皮肤上,用湿抹布擦掉表面的硫酸,然后用水冲洗,再涂上碳酸氢钠,所以B的叙述错误;做实验时,剩余试剂有些可以放回原试剂瓶,所以E也错误,选项是要选错误的故选择BE;(2) NaClO有强氧化性,能够氧化氯离子,产生氧气,其离子方程式为Cl-+ClO-+2H+ ="=" Cl2↑+H2O ;(3)中,A1(OH)3会溶于过量的盐酸,即Al(OH)3+3H+== Al3++3H2O,但是A1(OH)3不会溶于过量的NaOH溶液,即Al3++3NH3·H2O=A1(OH)3↓+3NH4+;(4)中,99.9999%的铁可以看出是纯铁,钢是合金,所以该铁硬度比钢小,熔点比钢高,在冷的浓硫酸中钝化,能够与盐酸反应,且与不锈钢成分不相同,故答案为AD;(5)向沸水中逐滴滴加饱和FeCl3溶液,得到了Fe(OH)3胶体,胶体的大小为1~100nm;(6)设FeO、Fe2O3的物质的量为x和y,依据题意可以知道 =4∶5,解得x=2y,所以Fe2+与Fe3+物质的量之比为1:1。
=4∶5,解得x=2y,所以Fe2+与Fe3+物质的量之比为1:1。
考点:实验基础知识、离子方程式、合金、简单化学计算
点评:本题综合考查了实验基础知识、离子方程式、合金、简单化学计算等,信息量比较大,但是本题难度不大。
本题难度:一般
5、选择题 下列实验操作中离子反应方程式错误的是( )
A.向NaHCO3溶液中滴加少量澄清石灰水; Ca2++2OH
参考答案:
本题解析:
本题难度:一般