阴离子
| NO3—、SO42—、Cl-
下图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27 g。常温下各烧杯中溶液的pH与电解时间t的关系如下图Ⅱ所示。据此回答下列问题:
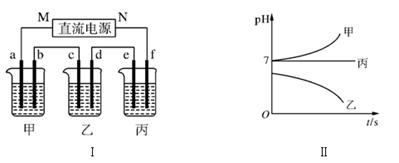
(1)M为电源的________(填“正”或“负”)极,A是________(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积:________。
(3)写出乙烧杯的电解池反应:________________________________________________。
(4)要使丙恢复到原来的状态,应加入________ g ________(填写化学式)。
参考答案:(12分,每空2分)
(1)负NaCl
(2)
本题解析:
试题分析:接通电源,经过一段时间后,测得乙中c电极质量增加了27 g,说明乙中含有金属阳离子,则乙中溶质是硝酸银,Ag++e-===Ag,得到27 g Ag,物质的量是27g/108g/mol=0.25mol,电路中通过的电子是0.25 mol。结合图Ⅱ,可知甲中溶液的pH增大是氯化钠,丙的pH不变是硫酸钠。
(1)c电极的质量增加,说明c电极有Ag析出,则c是阴极,b是阳极,a是阴极,所以M是电源的负极,甲中的溶液是NaCl溶液,产生的氢氧化钠使溶液pH增大;
(2)丙是硫酸钠,N是电源的正极,则f是阳极,阳极产生的气体是氧气,根据以上分析,转移0.25 mol电子产生0.25mol/4="0.0625" mol O2,标准状况下的体积是0.0625mol×22.4L/mol=1.4L;
(3)乙是硝酸银溶液,电解硝酸银溶液得到的产物是Ag、氧气和硝酸,化学方程式为4AgNO3+2H2O 4Ag+O2↑+4HNO3 4Ag+O2↑+4HNO3
(4)丙是硫酸钠溶液,电解硫酸钠溶液实质是电解水,根据(1)的计算结果,阳极产生0.0625mol氧气,阴极则产生0.125mol氢气,相当于电解0.125mol水,所以要使丙恢复到原来的状态,应加入0.125mol×18g/mol=2.25g的H2O。
考点:考查电解反应原理的应用,电解质溶液的判断,电源正负极的判断,氧化还原反应的计算
本题难度:一般
2、选择题 如图用石墨作电极的电解池中,放入某足量蓝色溶液500mL进行电解,观察到A电极表面有红色固体生成,B电极有无色气体生成;通电一段时间后,取出A电极,洗涤、干燥、称量,A电极增重1.6g。下列说法错误的是
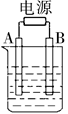
A.图中B极同电源正极相连
B.该蓝色溶液可能是Cu(NO3)2或CuCl2溶液[
C.电解后溶液的pH约为 1(溶液体积变化忽略不计)
D.要使电解后溶液恢复到电解前的状态,则可加入2 g CuO
参考答案:B
本题解析:
试题分析:根据现象判断蓝色溶液可为硫酸铜或硝酸铜溶液,A、电解时铜在阴极析出,氧气在阳极产生,B与电源的正极相连,正确;B、若电解CuCl2溶液阳极产生黄绿色气体,错误;C、根据电荷守恒,析出铜单质,氢离子补充,n(H+)="2" n(Cu2+)=2×1.6÷64=0.05mol,c(H+)=0.1mol/L,正确;D、电解时产生铜和氧气,加入n(CuO)= 1.6÷64×80=2g,正确。
本题难度:一般
3、填空题 铝和氯氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ______________________。
(2)铝与氢氧化钾溶液反应的离子方程式是____________________ 。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极板反应式是 _____________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因 ______________。
③除去杂质后的氢氧化钾溶液从液体出口 _________(填写“A”或“B”)导出。
参考答案:(1)2Al2O3![]() 本题解析: 本题解析:
本题难度:一般
4、选择题 实现反应:Cu+2H+=Cu2++H2↑,可以通过以下措施
A.将Cu投入稀硫酸中
B.让Cu在潮湿的环境发生电化学腐蚀
C.将Cu投入浓硫酸中并加热
D.用Cu作电极、稀硫酸作电解质溶液电解
参考答案:D
本题解析:
试题分析:A、将Cu投入稀硫酸中,铜和稀硫酸不反应,A错误;B、让Cu在潮湿的环境发生电化学腐蚀,发生的应该是吸氧腐蚀,B错误;C、将Cu投入浓硫酸中并加热生成SO2,C错误;D、用Cu作电极、稀硫酸作电解质溶液电解,铜是阳极失去电子,阴极氢离子发生生成氢气,D正确,答案选D。
考点:考查电化学原理的应用
本题难度:一般
5、填空题 电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:
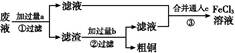
写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式 。
参考答案:Fe+Cu2+=Fe2++Cu ①

本题解析:根据题干信息可知废液应为FeCl3、CuCl2、FeCl2的混合溶液,加入的试剂a为Fe,发生反应为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,经①过滤后,滤渣是Fe与Cu的混合物,再加入过量的b(盐酸)发生反应:Fe+2HCl=FeCl2+H2↑,经②过滤后滤液主要是FeCl2溶液,将合并后的溶液中通入c(Cl2),发生主要反应为:2Fe2++Cl2=2Fe3++2Cl-。Fe+Cu2+=Fe2++Cu可以证明Fe比Cu还原性强,该反应在步骤①中发生。将Fe+Cu2+=Fe2++Cu设计成原电池,Fe作负极,比Fe不活泼的Cu作正极即可,电解质溶液是含Cu2+的溶液。电解精炼铜时,粗铜作阳极,精铜作阴极。
本题难度:一般
|
|