微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质能放在食品包装袋内的小袋中,以防止食品因被氧化而变质的是
A.硅胶
B.生石灰
C.活性炭
D.铁粉
参考答案:D
本题解析:
试题分析:A、硅胶具有吸水性,错误;B、生石灰具有吸水性,错误;C、活性炭具有吸附性,错误;D、铁粉可以和氧气发生反应,防止食品被氧化,正确。
考点:考查物质的性质。
本题难度:一般
2、填空题 (18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO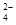 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
参考答案:(1)6KOH+3Cl2 本题解析:
本题解析:
试题分析:(1)据题目信息、氧化还原反应中化合价发生变化确定产物有:KClO3、KCl、H2O,根据电子得失守恒和质量守恒来配平,可得6KOH+3Cl2 KClO3+5KCl+3H2O;Cl2既是氧化剂又是还原剂,氯化合价升高,得到 KClO3,KClO3是还原产物。
KClO3+5KCl+3H2O;Cl2既是氧化剂又是还原剂,氯化合价升高,得到 KClO3,KClO3是还原产物。
(2)A、根据生产工艺流程图,第①步氯气过量,加入KOH固体后会继续反应生成KClO,正确;B、因温度较高时KOH 与Cl2 反应生成的是KClO3,而不是KClO,错误; C、第③步需要碱性条件,所以碱要过量,正确;D、KClO3转化为 KClO,化合价只降不升,错误。
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得2Fe3++3ClO-+10OH-=2FeO42-+
3Cl-+5H2O
(4)因只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净,所以检验方法为:用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净。
(5)根据电子得失守恒和质量守恒来配平,可得4FeO42-+10H2O
本题难度:困难
3、选择题 下列变化需要加入还原剂才能实现的( )
A.MnO4- Mn2+
Mn2+
B.HCl Cl2
Cl2
C.Fe Fe3+
Fe3+
D.KClO3 O2
O2
参考答案:A
本题解析:
试题分析:A、MnO4→Mn2+中,锰元素化合价降低,需要加入还原剂才能实现,正确;B、HCl→Cl2中,氯元素化合价升高,需要加入氧化剂才能实现,错误;C、Fe→Fe3+中,铁元素化合价价升高,需要加入氧化剂才能实现,错误; D、KClO3→O2中,氧元素化合价升高,在二氧化锰做催化剂条件下加热分解就能实现,错误.答案选A
考点:氧化剂还原剂的概念辨析
本题难度:一般
4、选择题 某元素在化学反应中,由化合态变为游离态,则该元素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.化合价降低为0
参考答案:C
本题解析:
试题分析:元素的化合态可能是正价,也可能是负价,所以从化合态变为游离态,化合价可能降低,也可能升高,所以可能被氧化也可能被还原。
考点:氧化还原反应。
本题难度:简单
5、选择题 普通玻璃的主要成分含有
A.CaCO3
B.⑤Na2CO3
C.Na2SiO3
D.CaO
参考答案:C
本题解析:普通玻璃的主要成分为硅酸钠、硅酸钙和二氧化硅。故C正确。
本题难度:简单