微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol
CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)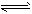 CH3OH(g)+H2O(g) △H=-49.0kJ/mol 测得CO2和
CH3OH(g)+H2O(g) △H=-49.0kJ/mol 测得CO2和
CH3OH(g)的浓度随时间变化如图。请回答
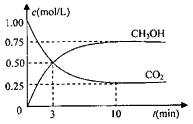
① 从反应开始到平衡,氢气的平均反应速率:v(H2)=________mol/(L·min)。
②升高温度,该反应的平衡常数的数值将________(填“增大”、“减小”或“不变”)。
③下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是________
A.加入催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入3molH2
(2)合成氨的热化学方程式为:N2(g)+3H2(g)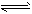 2NH3(g) △H=-92 kJ·mol-1。
2NH3(g) △H=-92 kJ·mol-1。
①某温度下,若把10mol N2与30mol H2置于体积为10L的密闭合成塔内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为1/5,则该温度下反应的K=___________(可用分数表示)。
②对于合成氨反应而言,下列有关图象一定正确的是(填序号)_______________
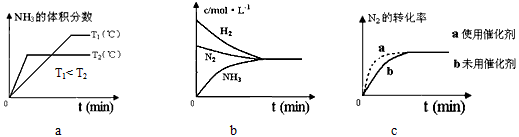
参考答案:(1)①0.225;②减小;③CD
(2)①1/12
本题解析:
本题难度:一般
2、选择题 一定温度下,某一密闭恒容的容器内存在可逆反应A(g)+3B(s)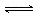 2C(g),可判断其达到化学平衡状态的是
2C(g),可判断其达到化学平衡状态的是
A.当生成C的速率为0时
B.容器内混合气体的密度不随时间而变化
C.单位时间内生成n molA,同时生成3n molB
D.A、B、C的分子数之比为1:3:2
参考答案:B
本题解析:
试题分析:A.当生成C的速率与消耗C的速率相等而且不为0时,反应达到平衡,错误。B.由于容器的容积不变,而气体的物质的量会发生变化,气体的质量也会发生变化,所以若容器内混合气体的密度不随时间而变化,则反应达到平衡,正确;C.无论反应是否达到平衡,单位时间内生成n molA,同时生成3n molB,因此不能判断反应达到平衡,正确;D.反应达到平衡时,A、B、C的分子数之比可能为1:3:2,也可能不是,这与加入的物质的量的多少有关,因此不能判断反应达到平衡状态,错误。
考点:考查可逆反应达到化学平衡状态的判断的标志的知识。
本题难度:一般
3、选择题 二氧化氮能形成二聚分子:2NO2(g)?N2O4(g);△H<0.现欲测定二氧化氮的相对分子质量,应采取的措施是( )
A.低温、高压
B.低温、低压
C.高温、低压
D.高温、高压
参考答案:由于存在平衡2NO2(g)?N2O4(g),N2O4的存在会
本题解析:
本题难度:一般
4、填空题 (6分)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题:
CH3OH(g)+H2O(g) △H =-49.0 kJ·mol-1 测得CH3OH的物质的量随时间变化如图所示,回答问题:

①该反应的平衡常数表达式为K= 。
②曲 线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“大于”、“等于”或“小于”)。
③其它条件不变时,下列措施能提高H2转化率的是 (填字母)。
A.减小CO2的浓度
B.降低温度
C.增加H2的浓度
D.增大压强
参考答案:①
本题解析:
本题难度:一般
5、选择题 将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡总压强/kPa
| 5.7
| 8.3
| 12.0
| 17.1
| 24.0
|
平衡气体总浓度/10-3mol/L
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
参考答案:C
本题解析:
试题分析:A、反应NH2COONH4(s) 2NH3(g)+CO2(g),生成的气体的物质的量之比始终是2:1,所以气体的平均相对分子质量始终不变,故不能作为平衡状态的判断依据,故A错误;B、从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;反应中固体变为气体,混乱度增大,△S>0,根据△G=△H-T△S可知反应在高温下自发进行,B错误;C、反应中生成的氨气和二氧化碳的浓度之比为2:1,总浓度为2.4×10-3mol/L,所以氨气的浓度为1.6×10-3mol/L,二氧化碳的浓度为8.0×10-4mol/L,所以平衡常数K=(1.6×10-3)2×8.0×10-4(mol/L)3=2.0×10-9(mol/L)3,故C正确;D、压缩容器体积,气体压强增大,平衡向逆向移动,氨基甲酸铵质量增加,,故D错误;答案选C。 2NH3(g)+CO2(g),生成的气体的物质的量之比始终是2:1,所以气体的平均相对分子质量始终不变,故不能作为平衡状态的判断依据,故A错误;B、从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,△H>0;反应中固体变为气体,混乱度增大,△S>0,根据△G=△H-T△S可知反应在高温下自发进行,B错误;C、反应中生成的氨气和二氧化碳的浓度之比为2:1,总浓度为2.4×10-3mol/L,所以氨气的浓度为1.6×10-3mol/L,二氧化碳的浓度为8.0×10-4mol/L,所以平衡常数K=(1.6×10-3)2×8.0×10-4(mol/L)3=2.0×10-9(mol/L)3,故C正确;D、压缩容器体积,气体压强增大,平衡向逆向移动,氨基甲酸铵质量增加,,故D错误;答案选C。
考点:考查平衡状态的判断、平衡常数的计算、平衡移动的影响因素等
本题难度:一般
|