微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
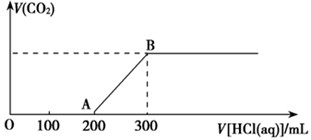
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式______________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
参考答案:(1)Na2CO3或NaHCO3(2分)NaOH和Na2CO
本题解析:(1)CO2和氢氧化钠溶液反应,可以生成碳酸钠,也可以生成碳酸氢钠。所以如果是单一成分,则可以是Na2CO3或NaHCO3;如果是多种成分,则可以是NaOH和Na2CO3或Na2CO3和NaHCO3。
(2)由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaCl=NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑。根据图像可知,生成CO2消耗盐酸的物质的量小于前面消耗的,这说明溶液中的溶质是氢氧化钠和碳酸钠。所以O到A点发生反应的离子方程式是OH- + H
本题难度:一般
2、选择题 在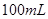
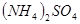 和
和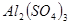 的混合溶液中,加入足量的
的混合溶液中,加入足量的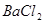 的溶液,生成
的溶液,生成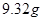 沉淀,再加入足量
沉淀,再加入足量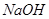 溶液并加热,生成
溶液并加热,生成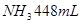 (标准状况),则原溶液中
(标准状况),则原溶液中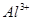 的浓度为
的浓度为
A.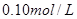
B.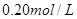
C.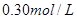
D.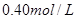
参考答案:B
本题解析:9.32g沉淀是硫酸钡,物质的量是9.32g÷233g/mol=0.04mol,所以SO42-的物质的量是0.04mol。氨气是0.448L÷22.4L/mol=0.02mol,则NH4+的物质的量是0.02mol。因此根据电荷守恒可知,溶液中Al3+的浓度是(0.04mol×2-0.02mol)÷3=0.02mol,因此浓度是0.02ml÷0.1L=0.2molL,答案选B。
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数的值,下列说法正确的是( )。
A.1 mol甲基(—CH3)中含有的电子数为7NA
B.25 ℃时,pH=7的NH4Cl和NH3·H2O的混合溶液中,OH-数为10-7NA
C.42 g丙烯中含有的共价键数目为9NA
D.两份均为2.7 g的铝样品分别与100 mL浓度均为2 mol·L-1的盐酸和氢
氧化钠溶液充分反应,转移的电子数均为0.3NA
参考答案: C
本题解析: 1 mol甲基中含有电子数为9NA,故A错误。B选选中未指明溶液的体积,无法计算OH-的数目,B错误。丙烯的结构式为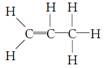 ,故C正确。2.7 g铝与100 mL 2 mol·L-1的盐酸反应时,盐酸的量不足,转移电子数为0.2NA,故D错误。
,故C正确。2.7 g铝与100 mL 2 mol·L-1的盐酸反应时,盐酸的量不足,转移电子数为0.2NA,故D错误。
本题难度:一般
4、实验题 (4分)实验室需要0.1mol/L硫酸950ml,某同学用98%的浓硫酸(密度为1.84g·cm-3)配制:
(1)需选用???????????容量瓶。
A.50m?????? B.100ml?????? C.250ml????????? D.1000ml
(2)需量取浓硫酸????????????ml。
(3)配制溶液时下列操作使所配溶液浓度偏大的是?????????????。
A.容量瓶中原有少量蒸馏水??????? B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时观察液面俯视??????????? D.溶液未经冷却即注入容量瓶
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤量取 ⑥转移溶液 ⑦定容
正确的操作顺序是???????????????????????(填序号)。
参考答案:(4分)(1) D???????(2)5.4ml??????
本题解析:
试题分析:(1)应用容量瓶的规格没有950ml的,所以应该配制1000ml的,答案选D。
(2)需要浓硫酸的体积是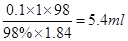 。
。
(3)根据c=n/V可知,如果容量瓶中原有少量蒸馏水,则不会影响实验结果;洗涤烧杯和玻璃棒的溶液未转入容量瓶中,则溶质减少,浓度降低;定容时观察液面俯视,则容量瓶中溶液的体积
本题难度:一般
5、选择题 标准状况下,m1g气体A与m2g气体B的分子数相等,下列说法中正确的是(??)
A.1个A分子的质量是1个B分子的质量的 倍
倍
B.同温同体积的A与B的质量比为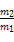
C.同温同质量的A与B的分子数比为
D.同温同压下A与B的密度比为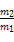
参考答案:A
本题解析:根据题意两者的分子数相等,则其物质的量相等,故可设A、B的摩尔质量分别为M1、M2,1个分子的质量分别为mA、mB则有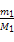 =
=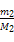 本题难度:一般
本题难度:一般