微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:____________。
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是________。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,则该反应的化学方程式为________,过氧化氢比理论用量稍多,其目的是________。反应温度最好控制在30 -70℃,温度不易过高,其主要原因是________。
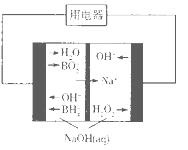
(4)下图是硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
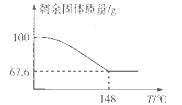
(5)Na2CO3·xH2O2可消毒、漂白。现称取100 g的Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为________。
参考答案:(1)H2O2+2H++2Fe2+=2Fe3++2H2O(2
本题解析:
试题分析:(1)酸性条件下H2O2氧化氯化亚铁生成氯化铁和水,反应的离子方程式为:
H2O2+2H++2Fe2+=2Fe3++2H2O;(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2;(3)氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中生成甲酸钙和水,该反应的化学方程式为:Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O;过氧化氢比理论用量稍多,其目的是:使甲醛充分氧化,提高甲醛的利用率和产品纯度,反应温度最好控制在30 -70℃,温度不易过高,其主要原因是:防止H2O2分解和甲醛挥发;(4)该装置为原电池,正极是阳离子流向的一极,即过氧化氢所在的一极,发生还原反应,电极反应式为H2O2+2e-=2OH-,溶液的pH增大;(5)设该晶体的组成为:Na2CO3·xH2O2:2Na2CO3?xH2O2 =2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所得固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为 68x /(212+68x)×100%=1-67.6%,解得x=1.5,则该晶体的组成为Na2CO3·1.5H2O2。
考点:考查氧化还原反应,离子方程式的书写,化学电源和化学式的确定。
本题难度:一般
2、选择题 固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应,下列判断正确的是 [???? ]
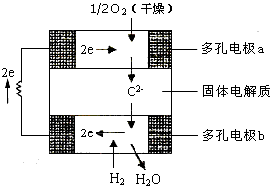
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为O2+2H2O+4e- = 4OH-
D.该电池的总反应方程式为
参考答案:D
本题解析:
本题难度:一般
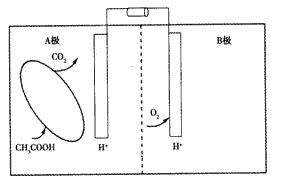
3、选择题 如图是一种微生物燃料电池的原理示意图。下列有关该微生物燃料电池的说法正确的是
?? [???? ]
A.A极为正极,B极为负极
B.电池内电解质溶液中所含的H+由B极移向A极
C.A极的电极反应为:CH3COOH-8e-+2H2O=2CO2 +8H+
D.电池工作过程中,电解质溶液的pH会明显下降
参考答案:C
本题解析:
本题难度:一般
4、选择题 铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是 [???? ]
A.蓄电池放电时,每消耗0.1 mol Pb,共生成0.1 mol PbSO4
B.电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小
D.蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变大
参考答案:B
本题解析:
本题难度:一般
5、选择题 氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。下列说法正确的是:
A.负极反应为:2H2+4OH- - 4e- = 4H2O
B.负极反应为:O2+2H2O+4e-= 4OH-
C.电池工作时溶液中的阴离子移向正极移动
D.电池工作时正极区pH升高,负极区pH下降
参考答案:AD
本题解析:
试题分析:A.通入氢气的电极为负极,在负极,氢气失去电子变为H+,H+与溶液中的OH-结合形成水,负极反应为:2H2+4OH- - 4e- =4H2O,正确;B.通入氧气的电极为正极,在正极,氧气得到电子,变为OH-,正极的电极反应式是:O2+2H2O+4e-= 4OH-,错误;C.根据同种电荷相互排斥,异种电荷相互吸引的原则,在电池工作时溶液中的阴离子移向正电荷较多的负极,错误;D.根据选项A、B分析可知,电池工作时负极区不断消耗OH-,溶液的pH下降,正极区不断产生OH-,溶液的pH升高,正确。
考点:考查燃料电池工作原理的知识。
本题难度:一般