微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1 mol?L-1 KHCO3溶液中下列表达式不正确的是
A.c(K +)+c(H+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
B.c(K+)> c (HCO3-)> c(OH-)> c(CO32-)> c(H+)
C.c(HCO3-)+ c(CO32-)+ c(H2 CO3)=" 0.1" mol?L-1
D.c(K+)> c(HCO3-)> c(OH-)> c(H+)> c(CO32-)
参考答案:B
本题解析:
试题分析:A正确,符合电荷守恒;碳酸氢钾的水解程度大于电离程度,溶液显碱性,B不正确,因为水还存在电离平衡,应该是c(K+)> c (HCO3-)> c(OH-)> c(H+)> c(CO32-),所以D不正确;C正确,符合物料守恒,答案选B。
点评:该题的关键是记住碳酸氢钾的水解程度大于电离程度,然后在依据电荷守恒、物料守恒和质子守恒进行判断。
本题难度:一般
2、选择题 下列有关溶液中微粒的物质的量浓度关系正确的是
A.某弱酸的酸式盐NaHA溶液中一定有:c(OH-)+2c(A2-)=c(H+)+c(H2A)
B.0.1 mol·L-1CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)> c(CH3COOH) > c(Cl-) >c(H+)
C.物质的量浓度相等的HCN溶液和NaCN溶液等体积混合后的溶液中:c(CN-)+2c(OH-)=2c(H+)+c(HCN)
D.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3·H2O)+c(Fe2+)=0.3 mol·L-1
参考答案:C
本题解析:
试题分析:A.根据电荷守恒可得c(OH-)+2c(A2-)=c(H+)+c(Na+)。错误。B.0.1 mol·L-1CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后发生反应CH3COONa+HCl=NaCl+CH3COOH。反应后含CH3COONa、 NaCl、CH3COOH等物质的量混合。因为溶液显酸性,则说明CH3COOH的电离大于CH3COO-水解。所以溶液显酸性。弱电解质的电离程度是很微弱的。所以c(Cl-) >c(H+)、因此该溶液中各离子浓度的大小关系为c(CH
本题难度:一般
3、选择题 已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O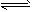 CH3COO-+H3O+? K1=1.75×10-5
CH3COO-+H3O+? K1=1.75×10-5
CH3COO-+H2O CH3COOH+OH-? K2 =5.71×10-10
CH3COOH+OH-? K2 =5.71×10-10
现将50 mL 0.2 mol/L醋酸与50 mL 0.2 mol/L醋酸钠溶液混合制得溶液甲,下列叙述正确的是 [???? ]
A.溶液甲的pH >7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的NaOH溶液,溶液的pH明显增大
D.若在溶液甲中加入5 mL 0.1 mol/L的盐酸,则溶液中醋酸的K1会变大
参考答案:B
本题解析:
本题难度:一般
4、选择题 物质的量浓度相同(0.2 mol/L)的弱酸HX与NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A.c(Na+)+c(H+)=c(X-)+c(OH-)
B.c(HX)+c(X-)=c(Na+)
C.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
参考答案:BD
本题解析:
试题分析:A、正确,为电荷守恒式。
B、错误,正确的应为c(HX)+c(X-)=2c(Na+).
C、正确,混合液为酸性,则说明HX的电离程度大于X-的水解程度,因此可得关系式:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)。
D、错误,混合液为碱性,则说明HX的电离程度小于X-的水解程度,因此可得关系式:c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+)。故选BD。
点评:此题考查电解质溶液的电离与水解,对于此类题型的解答,应先明确溶液中粒子的
本题难度:一般
5、选择题 下列物质在常温下发生水解时,对应的离子方程式正确的是()
A.Na2CO3: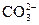 +2H2O
+2H2O H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4NO3: +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
C.CuSO4:Cu2++H2O Cu(OH)2+2H+
Cu(OH)2+2H+
D.KF:F-+H2O====HF+OH-
参考答案:B
本题解析:A.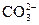 为弱酸根离子,分步水解,
为弱酸根离子,分步水解,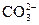 +H2O
+H2O 本题难度:简单
本题难度:简单