微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列有关图象,说法正确的是
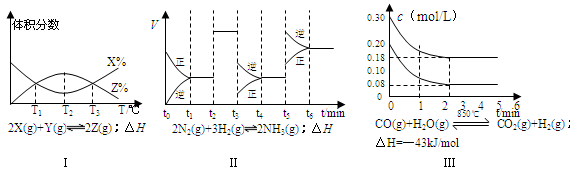
A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
参考答案:D
本题解析:A:T1时刻,反应达到平衡,平衡后继续升温,反应物X的量增大,平衡左移,则正反应的△H<0? B:由图知反应在t3、t6处均向逆向移动,故反应在t6时,NH3体积分数最小;C:t3时正逆反应速率均降低,且平衡向逆向移动,可知降低了压强;D:从图可知反应中各物质均有0.12 mol的物质的量的变化,反应放出5.16kJ的热量
本题难度:一般
2、填空题 (12分)在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)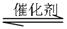 CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下 表:
表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
回答下列问题:
(1)该反应的化学平衡常数表达式为K=??????????????????。该反应为???????反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是???????????。
(a)容器中压强不变?????????????????????????????(b)混合气体中c(CO)不变
(c)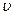 逆(H2)= 逆(H2)=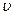 正(H2O)????????????????(d)c(CO2)=c(CO) 正(H2O)????????????????(d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡??????????????移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为?????????????????。
参考答案:(1) 本题解析:略 本题解析:略
本题难度:简单
3、选择题 在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g)?△H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示: nY(g)?△H=Q kJ·mol-1;反应达到平衡时,X的物质的量浓度与温度、气体体积的关系如下表所示:
?????????????容器体积/L
c(X)/mol·L—1
温度/℃
| 1
| 2
| 3
| 100
| 1.00
| 0.75
| 0.53
| 200
| 1.20
| 0. 90
| 0.63
| 300
| 1.30
| 1.00
| 0.70
?
下列说法正确的是(???? )
A.m>n
B.温度不变,增大体积,X的转化率增大
C.Q<0
D.体积不变,温度升高,平衡向正反应方向移动
参考答案:AC
本题解析:
试题分析:根据表格中数据分析,体积相同的时,温度升高,X的浓度不断增大,即平衡逆向移动,逆反应为吸热反应,正反应为放热反应,Q<0,C正确;温度相同时,增大容器体积为原来2倍,X的浓度瞬间减小为原来的0.5倍,但是X的浓度大于原来的0.5倍,说明平衡逆向移动,X的转化率减小,则前后气体系数m>n,A正确;故选AC。
本题难度:一般
4、填空题 现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
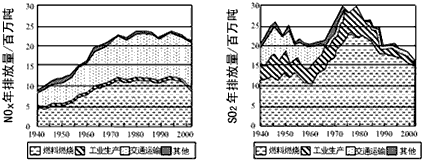
(1)结合上图数据,判断下列说法正确的是______。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量下降,主要是减少了燃烧的煤的量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:____________________。
(3)汽车排放的尾气中含有未燃烧充分的碳氢化合物以及N2、CO2、NO、CO等。有人设计利用反应
2NO+2CO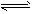 N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表 N2+2CO2将有害的污染物转化为可参与大气循环的N2和CO2。在某温度下用气体传感器测得不同时间的NO和CO浓度如下表

在上述条件下反应能够自发进行,则反应的△H_____0(“>”、“<”或“=”)。前2h内的平均反应速率v(N2)=______。据此你认为将该反应从理论转化为现实的最重要的研究方向是______________。
(4)某次降雨过程收集到10 L的雨水,向雨水中滴加1 mL 6 mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4 mol/L,再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为
0. 1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请写出将H2O2加入到雨水中与含硫化合物反应的离子方程式______________,并计算排放到空气中的NOx和SO2的物质的量之比接近于_______。
参考答案:(1)BD
(2)CaCO3+SO2=CaSO3+CO
本题解析:
本题难度:一般
5、选择题 在相同条件下(T=500k),相同体积甲、乙两容器,甲充入1g SO2、1g O2,乙充入2g SO2、2g O2.下列叙述错误的是
A.化学反应速率乙>甲
B.平衡后O2浓度乙>甲
C.SO2转化率乙>甲
D.平衡后SO2的体积分数乙>甲
参考答案:D
本题解析:A正确,化学反应速率与浓度大小有关,相同条件下,反应物的浓度越大,反应速率越快;B正确,由于乙的投量更多,即平衡后O2浓度乙>甲;C正确,乙的反应相当于两个甲叠加,即相当于增大压强,平衡向气体体积减少的方向移动,所以SO2转化率乙>甲;D错,由于乙的反应物转化率更高,所以平衡后SO2的体积分数甲>乙;
本题难度:困难
|
|