0.5
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂?? b.升高温度?? c.增大压强?? d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。
参考答案:(8分)(1)c4(NO)c6(H2O)/c4(NH3)c5
本题解析:略
本题难度:一般
2、选择题 把0.6 mol X气体和0.4 mol Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g) nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是 nZ(g)+2W(g),5 min末已生成0.2 mol W,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是
[???? ]
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
本题难度:简单
3、填空题 (11分)如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生如下反应:A(g) + 3B(g)  2C(g) 2C(g)
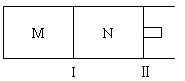
(1)向M、N中,各通入1mol A和3mol B。初始M、N容积相同,并保持温度不变。则到达平衡时A的转化率α(A)M????α(A)N??? A的体积分数x(A)M??????x(A)N
(2))向M、N中,各通入x molA和y molB,初始M、N容积相同,并保持温度不变。若要平衡时保持A气体在M、N两容器中的体积分数相等,则起始通入容器中的A的物质的量xmol与B的物质的量ymol之间必须满足的关系式为???????????????????
(3)若在某件下,反应A(g) + 3B(g)  2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为????????;保持温度和压强不变,向此容器内通入0.36mol A,平衡将????????(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由????????????????????????????? 2C(g)在容器N中达到平衡,测得容器中含有A 1.0mol,B 0.4mol,C 0.4mol,此时容积为2.0L。则此条件下的平衡常数为????????;保持温度和压强不变,向此容器内通入0.36mol A,平衡将????????(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由?????????????????????????????
?????????????????????????????????????????????????????????????????????????。
参考答案:(1)<???? >???(2)x=y(2分)
本题解析:
M、N分别是恒容和恒压条件,由于反应前后的气体系数和不一样,所以两个平衡态也不一样。要让M、N中平衡时A的体积分数一样,那么只能是M或N中,反应前后不论限度多少,A的体积分数始终为定值。
A(g) + 3B(g)  2C(g) 2C(g)
起始:??? x???? y
反应:??? z???? 3z??????? 2z
平衡:?? x-z??? y-3z?????? 2z
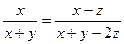 ,则x=y ,则x=y
(3)10(2分)???逆向(2分):原平衡体系中,2.0L容器中含有分子1.0+0.4+0.4=1.8mol,当加入A,体系瞬间有分子1.8+0.36=2.16mol。
瞬间总体积变为2.16×2.00/1.8=2.4L,所以:
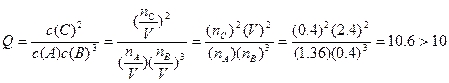 (4分) (4分)
本题难度:简单
4、填空题 (1)在密闭容器中进行下列反应:M(g) + N(g) R(g) + 2L(?),此反应规律符合下图图像。 R(g) + 2L(?),此反应规律符合下图图像。
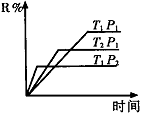
①T1??????T2??,正反应的△H??????0。(填“>”、“<”或“=”,下同)。
②P1????????P2? , L为???????。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)  ?2NH3(g)? ?2NH3(g)?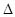 H=-92.4 kJ/mol,该反应的能量变化如图所示。 H=-92.4 kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是???????(填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量????92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是?????????(填字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入一定量H2
C.改变反应的催化剂
D.液化生成物分离出氨
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为?????????????mol、?????????????。
参考答案:(共12分)(1)①<、< ②<、气态 (2)①减小 ②<(
本题解析:
试题分析:(1)①根据图像可知,当压强均为P1时,温度为T2的曲线首先达到平衡状态,这说明温度是T2>T1。但温度高,R的含量低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
②根据图像可知,当温度均为T1时,压强为P2的曲线首先达到平衡状态,这说明P2>P1。但压强高,R的含量低,这说明增大越强平衡向逆反应方向移动,因此正方应是体积增大的可逆反应,即L一定是气态。
(2)①催化剂能降低反应的活化能,但不能改变反应热,所以在反应体系中加入催化剂,反应速率增大。由于E1减小,反应热不变,所以E2的变化一定是减小。
②由于该反应是可逆反应,因此若在一密闭容器中加入1molN2和3molH2,不可能生成2mol氨气,因此在一定条件下充分反应,放出的热量<92.4kJ。
③A、向容器中按原比例再充入原料气,相当于增大压强,平衡向正反应方向移动,氢气的转化率增大,A正确;B、向容器中再充入一定量H2,平衡向正反应方向,但氢气转化率降低,B不正确;C、改变反应的催化剂,反应速率变化,平衡状态不变,则氢气的转化率不变,C不正确;D、液化生成物分离出氨,降低生成物浓度,平衡向正反应方向移动,氢气的转化率增大,D正确,答案选AD。
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,这说明平衡应该是等效的。由于温度和容器容积不变,则氨气的物质的量完全转化为氮气和氢气应该是2mol和6mol,所以需要氨气的物质的量是4mol;平衡时生成氨气的物质的量是2mol×40%×2=1.6mol,因此如果从4mol氨气开始建立平衡状态,则氨气的转化率是=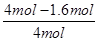 ×100%=60%。 ×100%=60%。
本题难度:困难
5、选择题 把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应
3X(g)+ Y(g)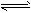 nZ(g)+ 2W(g),5min末已生成 0.2molW ,若测知以 Z 表示的平均反应速率为 0.01mol·L-1·min-1,则n是[???? ] nZ(g)+ 2W(g),5min末已生成 0.2molW ,若测知以 Z 表示的平均反应速率为 0.01mol·L-1·min-1,则n是[???? ]
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
本题难度:简单
|