微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中, 是氧化剂,氧化产物是 ,此反应中,HCl表现的性质有酸性和______性。
参考答案:KMnO4 ; Cl2 ; 还原。
本题解析:
试题分析:在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中,锰元素的化合价由+7价降低到+2价,KMnO4是氧化剂,氯元素由—1价升高到0价,氧化产物是氯气,此反应中,HCl表现的性质有酸性和还原性。
考点:考查氧化还原反应。
本题难度:一般
2、选择题 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是?
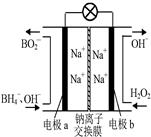
A.电池放电时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移的电子为3mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O
参考答案:D
本题解析:试题分析:以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,然后再结合原电池的工作原理和解答该题。
A.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故A不正确;
B.正极电极反应式为H2O2+2e-=2OH-,每消耗3molH2O2,转移的电子为6mol,故B错误;
C.电极b采用MnO2为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,故C不正确;
D.负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故D正确,答案选D。
考点:考查原电池工作原理
点评:该题是中等难度的试题,试题综合性强。主要是考查学生对电解原理的熟悉了解程度,本题涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,注意从化合价的变化分析和判断。
本题难度:简单
3、选择题 下表中对应关系错误的是
A
| NaCl=Na++Cl-;NH3?H2O NH4++OH- NH4++OH-
| 均属于电离方程式
|
B
| Ba2++SO42-=BaSO4↓;
HCO3-+OH-=CO32-+H2O
| 均可表示一类反应
|
C
| SO2使酸性高锰酸钾溶液褪色;
SO2使碱性酚酞溶液褪色
| 均属于SO2的同一性质
|
D
| Cl2+2NaOH=NaCl+NaClO+H2O;
3S+ 6NaOH=2Na2S+Na2SO3+3H2O;
| Cl2和S在反应中既作氧化剂又作还原剂
参考答案:C
本题解析:
试题分析:A.NaCl、NH3?H2O都是电解质,上述表示的是电离方程式。前者完全电离,电离方程式用等号:“===”,后者是弱电解质,电离方程式用可逆号:“ ”,正确;B.两个式子都是离子方程式,是表示一类反应,正确;C. SO2使酸性高锰酸钾溶液褪色,是由于SO2的还原性,被酸性高锰酸钾溶液氧化,后者是由于SO2是酸性气体,与碱发生反应使溶液的碱性减弱,所以酚酞溶液红色褪去,褪色的原因不同,错误;D.在这两个反应中,元素Cl、S化合价既升高,又降低,因此都是在反应中既作氧化剂又作还原剂,正确。 ”,正确;B.两个式子都是离子方程式,是表示一类反应,正确;C. SO2使酸性高锰酸钾溶液褪色,是由于SO2的还原性,被酸性高锰酸钾溶液氧化,后者是由于SO2是酸性气体,与碱发生反应使溶液的碱性减弱,所以酚酞溶液红色褪去,褪色的原因不同,错误;D.在这两个反应中,元素Cl、S化合价既升高,又降低,因此都是在反应中既作氧化剂又作还原剂,正确。
考点:考查化学符号或方程式、现象的原因解释的正误判断的知识。
本题难度:一般
4、选择题 下表中对应关系正确的是
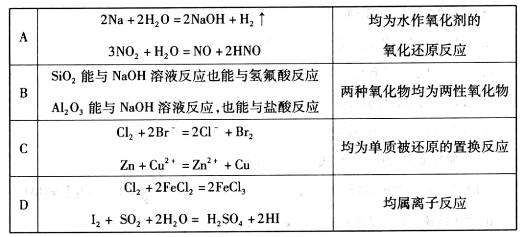
参考答案:D
本题解析:
试题分析:A、NO2与水的反应中NO2既是氧化剂,也是还原剂,水不是氧化剂,也不是还原剂,A错误;B、能与碱反应生成盐和水的氧化物是酸性氧化物,既能与碱反应生成盐和水,也能与酸反应生成盐和水的氧化物是两性氧化物。二氧化硅只能与氢氟酸反应生成四氟化硅和水,属于酸性氧化物,氧化铝是两性氧化物,B错误;C、锌置换铜的反应中锌元素的化合价降低,被氧化,C错误;D、反应中均离子参加或生成,属于离子反应,D正确,答案选D。
考点:考查氧化还原反应、离子反应以及两性氧化物等有关判断
本题难度:一般
5、选择题 对于反应:H-+NH3=H2+NH2-,下列说法正确的是
A.属于置换反应
B.H-既是氧化剂又是还原剂
C.NH3既是氧化剂又是还原剂
D.H2既是氧化产物又是还原产物
参考答案:D
本题解析:
试题分析:置换反应是一种单质和一种化合物反应生成一种新的单质和新的化合物的反应 所以A错。H- 得电子化合价升高到0价是还原剂所以B错, NH3 中元素化合价都没有变化既不是氧化剂也不是还原剂 所以C错。D,既是得电子的产物又是失电子的产物,所以D正确。
考点:考查氧化还原反应的相关概念。
本题难度:一般
|