微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式错误的是????????????????????????????????????????????
A.NaOH=Na++OH-
B.CuSO4=Cu2++SO42-
C.H2SO4=2H++SO42-
D.KMnO4=K++Mn2+-+4O2-
参考答案:D
本题解析:略
本题难度:简单
2、选择题 甲酸(HCOOH)的下列性质中,可以证明它是弱电解质的是
A.甲酸溶液中有大量的HCOOH分子和H+、HCOO—
B.甲酸能与水以任意比例互溶
C.10mL 1 mol/L甲酸恰好与10mL 1 mol/LNaOH溶液完全反应
D.在相同温度下,相同浓度的甲酸溶液的导电性比盐酸弱
参考答案:AD
本题解析:
试题分析: A、甲酸溶液中有大量的HCOOH分子和H+、HCOO—,表明该酸没完全电离,是弱电解质,正确;B、甲酸能与水以任意比例互溶,并不能说明该酸是不是能够完全电离,错误;C、10mL 1 mol/L甲酸恰好与10mL 1 mol/LNaOH溶液完全反应,不能说明该酸是不是能够完全电离,错误;D、在相同温度下,相同浓度的甲酸溶液的导电性比盐酸弱,导电性弱,表明没有完全电离,正确。
本题难度:一般
3、选择题 在100ml下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是
A.蒸馏水
B.0.5mol/L的CH3COOH
C.0.5mol/L的HCl
D.0.5mol/L的氨水
参考答案:C
本题解析:
试题分析:溶液的导电性强弱主要和溶液中离子浓度大小以及离子的电荷数有关系。离子浓度越大,电荷数越多,溶液导电性越强。A中离子浓度增加,导电性增强;B中有强电解质醋酸钠生成,导电性增强;C中生成氯化钠,导电性变化不大;D中离子浓度增大,导电性增强,答案选C。
点评:该题的关键是理解溶液的导电性和离子的种类、个数多少无关系。主要是看溶液中离子浓度的大小和离子电荷数,据此可以判断。同时还需要熟练记住常见的强电解质。
本题难度:一般
4、选择题 某温度下,已知CH3COOH、HClO、H2CO3、H3PO4 电离平衡常数如下表所示,则0.1mol·L-1的下列各溶液pH最大的是(???)
表:几种弱酸的电离平衡常数
酸
| 电离常数
|
CH3COOH
| Ka=1.8×10-5
|
HClO
| Ka=3.0×10-8
|
H2CO3
| Ka1=4.3×10-7,Ka2=5.6×10-11
|
H3PO4
| Ka1=7.5×10-3,Ka2=6.2×10-8,Ka3=2.2×10-13
A.CH3COONa?????????B.NaClO????????C.Na2CO3??????????D.Na3PO4
参考答案:D
本题解析:根据电离平衡常数可知,HPO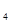  的电离平衡常数最小,酸性最弱,所以其对应的强碱弱酸盐水解程度最大,碱性最强,故选D 的电离平衡常数最小,酸性最弱,所以其对应的强碱弱酸盐水解程度最大,碱性最强,故选D
本题难度:一般
5、选择题 等量的NaOH分别与pH=3和pH=4的醋酸恰好中和,消耗二者的体积依次为V1和V2,则V1、V2的关系为
A.V2=10V1
B.V1<10 V2、
C.10V1>V2
D.V2>10V1
参考答案:D
本题解析:
试题分析:醋酸和氢氧化钠恰好中和说明醋酸和氢氧化钠物质的量相等,即: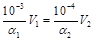 。 。
浓度越大,电离度越小,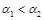 ,所以 ,所以
本题难度:一般
|