微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.n(OH-)
D.c(H﹢)
参考答案:B
本题解析:
试题分析:氨水是弱碱,存在电离平衡,稀释促进电离,OH-的物质的量增加,但浓度减小,所以氢离子的浓度增加。NH3·H2O的物质的量减小,浓度减小,所以溶液中随着水量的增加而减小的是c(NH3·H2O)/c(OH-),答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强,侧重学生能力的培养和学习方法的指导。该题的关键是明确影响弱电解质的电离平衡因素,以及离子物质的量与物质的量浓度变化的关系,有助于培养学生的逻辑推理能力和灵活应变能力。
本题难度:简单
2、填空题 在相应的空格内填写大于、等于或小于:
(1)分别取pH=2的硫酸和醋酸各50mL,加入足量的镁粉,反应开始时,反应速率前者_________后者;充分反应后,相同条件下产生氢气的体积前者_________后者。
(2)等浓度等体积的盐酸和醋酸,分别与等浓度的NaOH溶液反应,恰好中和时,消耗NaOH的体积前者__________后者,所得溶液的pH前者________后者。
参考答案:(1)等于;小于
(2)等于;小于
本题解析:
本题难度:一般
3、实验题 (10分)某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一?配制醋酸溶液的浓度取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
配制250 mL 0.2 mol/L 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________________和_________________。
实验二?探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度(mol/L)
| 0.0010
| 0.0100
| 0.0200
| 0.1000
| 0.2000
|
pH
| 3.88
| 3.38
| 3.23
| 2.88
| 2.73
?回答下列问题:
⑶根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
_______________________________________________________________________________
_____________________________________________ ____________________________________ ____________________________________
⑷从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度____________。
(填增大、减小或不变)
实验三?探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案_________________________
_____________________________________________。
参考答案:
(10分,每空2分)(1)胶头滴管? 250mL容量
本题解析:略
本题难度:一般
4、选择题 向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.65gZn,则下图中比较符合客观事实的曲线是
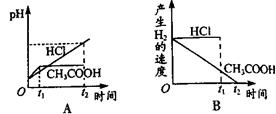 
参考答案:CD
本题解析:
试题分析:0.65g锌的物质的量=0.65g÷65g/mol=0.01mol,需要盐酸和醋酸的物质的量都是0.02mol。盐酸是强酸,醋酸是弱酸,在pH都是2的情况下盐酸的浓度是0.01mol/L,而醋酸的浓度大于0.01mol/L。溶液的体积都是1L,因此盐酸的物质的量是0.01mol,醋酸的物质的量大于0.01mol。所以与0.65g锌反应时盐酸不足,醋酸过量,即醋酸产生的氢气多,在反应过程中醋酸还可以继续电离出氢离子,醋酸溶液中氢离子浓度大于盐酸溶液中氢离子浓度,所以醋酸的反应速率快,选CD。
考点:考查盐酸、醋酸与锌反应的有关判断、计算以及图像分析。
本题难度:一般
5、填空题 (6分)写出下列物质在水溶液中的电离方程式或离子水解方程式。
1、写出下列三种物质的电离方程式
(1) HClO 。
(2)CH3COONa 。
(3)NH3·H2O 。
2、写出下列三种物质的离子水解方程式
(4)CH3COONa 。
(5)NH4Cl 。
(6)NaF 。
参考答案:(6分)(每小题1分)(1) HClO
本题解析:
试题分析:醋酸钠是强电解质,用等号连接,次氯酸和氨水都是弱电解质,用可逆号连接,因此正确的电离方程式是(1) HClO H+ + ClO-;(2) CH3COONa =CH3COO- + Na+ ;(3) NH3·H2O H+ + ClO-;(2) CH3COONa =CH3COO- + Na+ ;(3) NH3·H2O  NH4+ + OH-;醋酸钠和氟化钠都是强碱弱酸盐,水解显碱性。氯化铵是强酸弱碱盐,水解显酸性。由于水解都是可逆的,所以水解方程式分别是(4) CH3COO- + H2O NH4+ + OH-;醋酸钠和氟化钠都是强碱弱酸盐,水解显碱性。氯化铵是强酸弱碱盐,水解显酸性。由于水解都是可逆的,所以水解方程式分别是(4) CH3COO- + H2O  CH3COOH + OH-;(5) NH4+ + H2O CH3COOH + OH-;(5) NH4+ + H2O  NH3·H2O + H+;(6) F- + H2O NH3·H2O + H+;(6) F- + H2O  HF + OH-。 HF + OH-。
考点:考查电离方程式和水解方程式的书写
点评:书写电离方程式时首先要判断电解质的强弱,然后在依据具体的电解质书写;而水解方程式的书写,则需要注意水解反应一般都是可逆的,其次还要注意多元弱酸根以及多元弱碱离子的不同。再就是水解的程度一般都很小,一般不能标出“↑”或“↓”。
本题难度:一般
|