微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列依据热化学方程式得出的结论正确的是? [???? ]
A.已知2H2(g)+O2(g)=2H2O(l) △H= -483.6kJ·mol-1,则氨气的燃烧热为483.6kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.已知2C(s) +2O2(g)=2CO2 (g) △H1 2C(s) +O2(g)=2CO(g) △H2,则△H1>△H2
D.已知Ni(CO)4(s)=Ni(s)+4CO(g) △H= Q kJ·mol-1,则Ni(s) +4CO(g)=Ni(CO)4(s) △H= - QkJ·mol-1
参考答案:D
本题解析:
本题难度:一般
2、选择题 把80mlNaOH溶液加入到120ml盐酸中,所得溶液的PH值为2(设混合后溶液总体积为原溶液体积之和)。如果混合前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是(???)
A.0.05mol/L
B.0.1mol/L
C.1.0mol/L
D.0.5mol/L
参考答案:A
本题解析:设它们的浓度均为 ,则
,则 ,
, 本题难度:一般
本题难度:一般
3、选择题 沼气的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是:
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol
D.1/2 CH4(g)+ O2(g)=1/2CO2(g)+ H2O(g) △H=-890kJ/mol
参考答案:C
本题解析:A错,甲烷燃烧为放热反应,应用“—”表示;B错,理由同A;C正确;D错,水应为液态水;
本题难度:一般
4、填空题 已知下列热化学方程式:
①H2(g)+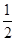 O2(g)=H2O(l)ΔH=-285.8 kJ/mol
O2(g)=H2O(l)ΔH=-285.8 kJ/mol
②H2(g)+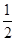 O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+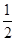 O2(g)=CO(g)ΔH=-110.5 kJ/mol
O2(g)=CO(g)ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ,C的燃烧热为 。
(3)燃烧10 g H2生成液态水,放出的热量为 。
(4)CO的燃烧热为 ,其热化学方程式为 。
参考答案:(1)①②③④
(2)285.8 kJ/mol 393
本题解析:(1)所有燃烧均为放热反应,故①②③④均为放热反应。
(2)燃烧热为1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,H2的燃烧热为285.8 kJ/mol,C的燃烧热为393.5 kJ/mol。
(3)Q放=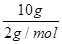 ×285.8 kJ/mol=1 429.0 kJ。
×285.8 kJ/mol=1 429.0 kJ。
(4)由④-③可得,CO(g)+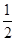 O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol),
O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol),
故CO的燃烧热为283.0 kJ/mol。
本题难度:一般
5、填空题 (10分)在一定温度下,醋酸溶液存在电离平衡:
CH3COOH? ??CH3COO- + H+
??CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值?? _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)="________________mol/L" (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________? c2(H+)(填“大于”、“小于”或“等于”)
参考答案:(10分)(1)<?(2)①? 本题解析:(1)醋酸是弱酸,存在电离平衡,所以浓度越大,电离程度越小,所以0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值小于10。
本题解析:(1)醋酸是弱酸,存在电离平衡,所以浓度越大,电离程度越小,所以0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值小于10。
(2)①醋酸的电离方程式为CH3COOH CH3COO-+H+,所以根据醋酸的电离平衡常数表达式
CH3COO-+H+,所以根据醋酸的电离平衡常数表达式 本题难度:一般
本题难度:一般