微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,将0.06mol/L的H2SO4溶液和0.10mol/L的NaOH等体积混合后,溶液的PH为
A:1.7?????????? B:2.0?????????? C:12.0??????????? D:12.3
参考答案:C
本题解析:略
本题难度:一般
2、计算题 燃烧6g碳全部生成气体时放出的热量,如果全部被水吸收,可使1kg水由20℃升高到67℃,水的比热容为4.2kJ·(kg·℃)-1,求碳的燃烧热?
参考答案:394.8 kJ/mol
本题解析:
试题分析:1kg水由20℃升高到67℃,则需要吸收的热量是1000g×4.2kJ·(kg·℃)-1×(67℃-20℃)=197400J=197.4kJ。6g是0.5mol,又因为燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以碳的燃烧热是197.4kJ/mol×2=394.8 kJ/mol。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识对训练,主要是考查学生对燃烧热概念的熟悉了解程度,有助于培养学生的逻辑推理能力,提高学生的应试能力和学习效率
本题难度:简单
3、选择题 已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A.HF与CaCl2反应产生沉淀
B.25℃时0.2mol·L-1HF溶液中pH=2
C.Ksp(CaF2)随温度和浓度的变化而变化
D.该体系中最终没有氟化氢分子
参考答案:A
本题解析:混合后氟离子和钙离子的浓度分别是6×10-3mol/L和0.1mol/L,此时c(F-)2·c(Ca2+)=3.6×10-5>.46×10-10,所以能产生沉淀,A正确。25℃时0.2mol·L-1HF溶液中氢离子浓度是8.5×10-3mol/L,B不正确。溶度积常数只与温度有关系,C不正确。氟化氢是弱电解质,始终存在电离平衡,即溶液中一定含有氟化氢分子,D不正确,答案选A。
本题难度:一般
4、填空题 (9分)(1)Na2CO3的水溶液呈?????????(填“酸”、“中”、“碱”)性,常温时的pH ???7(填“>”、“=”、“<”),原因是(用离子方程式表示):?????????????????????????;???????(2)氯化铝水溶液呈???????性,原因是(用离子方程式表示):_____________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是??????。
参考答案:(1)碱性;(1分)? > (1分); CO32-+H
本题解析:(1)碳酸钠是强碱弱酸盐,水解显碱性,显÷常温下pH大于7,水解方程式为CO32-+H2O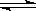 HCO3-+OH-。
HCO3-+OH-。
(2)氯化铝是强酸弱碱盐,水解显酸性,水解方程式为Al3++3H2O 本题难度:简单
本题难度:简单
5、选择题 某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液:
① 0.01mol?L1的H2A溶液
② 0.01mol?L1的NaHA溶液
③ 0.02mol?L1的HCl溶液与0.04mol?L1的NaHA溶液等体积混合
④ 0.02mol?L1的NaOH溶液与0.02mol?L1的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是(???)
A.溶液②中存在水解平衡:HA―+H2O 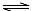 H2A+OH―
H2A+OH―
B.溶液③中有:c(HA-)+2c(A2-)=c(Na+)
C.溶液④中有:c(OH-)=c(H+)+c(HA-)
D.四种溶液中c (HA-)浓度大小:③>①>②>④
参考答案:CD
本题解析:
试题分析:二元酸H2A在水溶液中发生电离:H2A=H++HA-,HA- H++A2-,这说明是二元酸的第一步电离是完全的,而第二步电离存在电离平衡。因此HA-离子只存在电离平衡,不存在水解平衡,溶液显酸性,选项A不正确;B不正确,不符合物料守恒,应该是c(HA-)+c(A2-)=c(Na+);④中恰好反应
H++A2-,这说明是二元酸的第一步电离是完全的,而第二步电离存在电离平衡。因此HA-离子只存在电离平衡,不存在水解平衡,溶液显酸性,选项A不正确;B不正确,不符合物料守恒,应该是c(HA-)+c(A2-)=c(Na+);④中恰好反应
本题难度:困难