微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)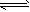 pC(g)。
pC(g)。
(1)欲使A与B的转化率等于m:n,则起始加入A、B的物质的量之比为__________;
(2)充入一定量的A、B,若在不同条件下C的体积分数随时间的变化如图所示,则:m+n______p(填“>”、“<”或“=”),该反应的△H________0(“>”、“<”或“=”)。

参考答案:(1)1:1
(2)<;>
本题解析:
本题难度:一般
2、选择题 在体积可变的密闭容器中,反应mA(g)+nB(s)?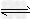 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低.下列说法中,正确的是[???? ]
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低.下列说法中,正确的是[???? ]
A.(m+n)必定小于p??
B.(m+n)必定大于p
C.m必定小于p??
D.m必定大于p
参考答案:C
本题解析:
本题难度:一般
3、选择题 对于密闭容器中的可逆反应:mX(g)+nY(s)?pZ(g);△H<0,达化学平衡后,改变条件,下列表述不正确的是( )
A.增大压强,化学平衡不一定发生移动(m、p代表任意正整数)
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其它条件不变,升高温度,化学平衡一定发生移动
参考答案:A.通过改变体积增大压强,若反应气体气体的体积不变,平衡不移
本题解析:
本题难度:简单
4、填空题 已知2SO2(g)+O2(g) 2SO3(g);△H<0的实验数据如下表:
2SO3(g);△H<0的实验数据如下表:
温度
| 不同压强下SO2的转化率(%)
|
1×105Pa
| 5×105Pa
| 1×106Pa
| 5×106Pa
| 1×107Pa
|
450℃
| 97.5
| 98.9
| 99.2
| 99.6
| 99.7
|
550℃
| 85.6
| 92.9
| 94.9
| 97.7
| 98.3
(1)应选的温度是????????????????????。
(2)应采用的压强是????????????????????,理由是??????????????????????????????。
(3)在合成的SO3过程中,不需要分离出SO3的原因是?????????????????????????????。
参考答案:(1)450℃;(2)1×105Pa?因为常压下SO2的转化
本题解析:工业生产中既要考虑反应速率快,又要考虑原料转化率高,同时也要考虑实现条件的限制。当它们出现矛盾时,两者都要兼顾,特别要适应催化剂的活性。该反应与合成氨相似,但实际情况又不完全相同,故解题时应理论联系实际,依据合成SO3的实验数据来解答。该反应与合成氨的反应相似:都是气体体积缩小的放热反应,温度升高有利于加快反应速率,但降低了反应物的转化率,适宜的条件的选择需要综合考虑。增大压强有利于加快反应速率,同时也提高了反应物的转化率,但压强对SO2的转化率影响不大,同时加压需要动力因素、设备耐压因素,综合经济效益,
本题难度:一般
5、选择题 一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:
3H2(g)+SO2(g) 2H2O(g)+H2S(g) 2H2O(g)+H2S(g)
容器编号
| 温度/℃
| 起始物质的量/mol
| 平衡物质的量/mol
| H2
| SO2
| H2
| SO2
| 容器I
| 300
| 0.3
| 0.1
| /
| 0.02
| 容器II
| 300
| 0.6
| 0.2
| /
| /
| 容器III
| 240
| 0.3
| 0.1
| /
| 0.01
下列说法正确的是
A.该反应正反应为吸热反应
B.容器II达到平衡时SO2的转化率比容器I小
C.容器III达到平衡的时间比容器I短
D.240℃时,该反应的平衡常数为1.08×104L? mol-1
参考答案:D
本题解析:
试题分析:A、分析容器Ⅰ和容器Ⅲ中的数据知,降低温度,SO2的物质的量减少,平衡正向移动,该反应正反应为放热反应,错误;B、容器II相当于容器Ⅰ的体积缩小为原来的一半,平衡正向移动,达到平衡时SO2的转化率比容器I大,错误;C、容器Ⅰ的反应温度比容器Ⅲ高,反应速率快,容器III达到平衡的时间比容器I长,错误;D、分析容器Ⅲ中数据知,240℃时,[SO2]= 0.01mol/L,[H2]= 0.03mol/L,[H2O]= 0.18mol/L,[H2S]= 0.09mol/L,代入平衡常数表达式计算,该反应的平衡常数为1.08×104L? mol-1,正确。
考点:考查化学平衡的移动、数据分析能力。
本题难度:困难
|
|