微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3·H2O、Na2CO3中的一种。常温下如下实验:
①将0.1L?pH=9的甲溶液分别与a?L?0.001mol/L的乙溶液、b?L0.001lmol/L的丁溶液充分反应后溶液呈中性时,a>b;
②浓度均为0.1?mol/L的丙和丁溶液等体积混合后,溶液呈酸性;?
③0.1mol/L的甲溶液pH小于0.1mol/L?的戊溶液pH。
下列判断正确的是 [???? ]
A.甲的溶质是NH3·H2O???????????????
B.丙的溶质NaOH ????
C.乙的溶质是CH3COOH????????????????
D.戊的溶质是HCl
参考答案:C
本题解析:
本题难度:一般
2、选择题 为了增大氯水中的HClO浓度,应采取的措施是
A.加入NaOH固体
B.加入食盐固体
C.加入CaCO3固体
D.加入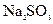 固体
固体
参考答案:C
本题解析:略
本题难度:一般
3、简答题 二元弱酸是分步电离的,25时碳酸和草酸的Ka如表:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2
Ka2=5.6×10-11
Ka2=5.42×10-5
(l)设有下列四种溶液:
A.0.1mol?L-1的Na2C2O4溶液B.0.1mol?L-1的NaHC2O4溶液
C.0.1mol?L-1的Na2CO3溶液D.0.1mol的NaHCO3溶液
其中,c(H+)最大的是______,c(OH-)最大的是______.
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示.
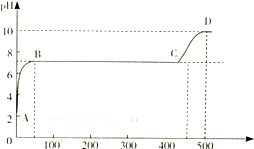
刚开始滴人碳酸钠溶液时发生反应的离子方程式为______,BC段发生反应的离子方程式为______,D点时混合溶液中由水电离产生的c(OH-)=______mol?L-1.
参考答案:(1)相同条件下,酸的电离平衡常数越大,则酸的酸性越强,酸根
本题解析:
本题难度:一般
4、选择题 弱电解质的电离程度可用电离度(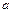 )表示: )表示: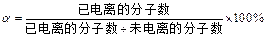 ,现有pH均为4的HCl和 ,现有pH均为4的HCl和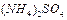 溶液,则两种溶液中H2O的电离度之比为( ) 溶液,则两种溶液中H2O的电离度之比为( )
A.1:2
B.2:5
C.1:106
D.106:1
参考答案:C
本题解析:略
本题难度:简单
5、选择题 H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A,②开始反应时的速率A>B,③参加反应的锌的物质的量A=B,④反应过程的平均速率 B>A?⑤盐酸里有锌剩余?⑥醋酸里有锌剩余
A.③④⑥
B.②③⑥
C.③④⑤
D.①②⑤
参考答案:C
本题解析:因为H+浓度相同,所以,盐酸浓度小于醋酸,又因体积相等,故盐酸物质的量比醋酸小,如果仅一种溶液剩余锌,肯定是盐酸中锌有剩余,⑤对,⑥错误,开始反应时,氢离子浓度相等,反应速率相等,但反应一旦开始,盐酸中氢离子浓度小于醋酸,故盐酸反应速率比醋酸慢,②错误,④正确,需要的时间盐酸长,①错误,生成氢气的质量相等,所以,参加反应的锌的质量相等,③正确,故选C。
本题难度:一般
|