微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学是以一门实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是
A.向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色
B.向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色
C.向Fe(NO3) 2溶液中滴加稀硫酸,能使溶液变为棕黄色
2溶液中滴加稀硫酸,能使溶液变为棕黄色
D.将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅
参考答案:D
本题解析:略
本题难度:一般
2、实验题 (12分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平,不考虑2NO2??N2O4)。
(1)硝酸在该反应中体现的性质是________。
(2)0.004 mol Cu被硝酸完全溶解后,Cu失去的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________;所得溶液(假设溶质不扩散)的物质的量浓度是________。
(3)如果参加反应的Cu和HNO3的物质的量之比是3∶10,写出并配平该反应的离子方程式______________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________________________。
参考答案:(1)氧化性、酸性
(2)0.008NA(答0.008
本题解析:铜与浓、稀硝酸反应时,遵循电子守恒和氮元素的原子守恒,硝酸的作用为氧化剂和酸,HNO3还原产物不论是NO2,还是NO,或者两者的混合物,电子均来自铜,即:n(NO2)+3n(NO)=2n(Cu)。若将等物质的量的NO和NO2的混合气体倒置于水中,再通入O2后无气体剩余,发生的反应相当于NO+NO2+O2+H2O===2HNO3,即可求得溶液浓度。
本题难度:一般
3、填空题 (10分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取铁酸钠的化学方程式是(未配平):

(1) 铁酸钠中,铁元素的化合价是??????;上述制取铁酸钠的反应中,铁元素被????????。
(2) 铁酸钠溶解于水,立即与水发生剧烈反应,放出氧气,正是这些在水中新产生出的氧原子发挥其极强的氧化能力给水杀菌消毒的。铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体,使水中悬浮物沉聚, Fe(OH)3胶体微粒直径的范围是____________nm,实验室制备Fe(OH)3胶体的化学方程式为______________________________.铁酸钠的电离方程式是________________________。
参考答案:(10分)
(1) +6 氧化 (2) 1-1
本题解析:略
本题难度:一般
4、选择题 铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 (????)
A.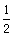 (a+b) mol
(a+b) mol
B.(a-b) mol
C.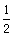 (a-b)mol
(a-b)mol
D.(a+b) mol
参考答案:A
本题解析:
试题分析:发生的反应为:①Fe2O3+6HCl=2FeCl3+3H2O; ②2FeCl3+Fe=3FeCl2. ③Fe+2HCl= FeCl2+H2↑.由于向反应后的溶液中加入KSCN溶液不显红色,说明溶液中不含有Fe3+.完全为Fe2+.由③可得Fe-- H2。n(H2)=n(Fe)=bmol,,则还有 (a-b)mol.由①②可得Fe2O3---2FeCl3----Fe可知发生该反应的Fe的物质的量为(a-b)mol÷2="(a-b)/2" mol因此在固体混合物中的铁粉的物质的量为bmol+
本题难度:一般
5、选择题 将一定量的FeO、Fe2O3、Fe3O4混合粉末与一定量铝粉均匀配成铝热剂并分成两份,第一份在高温下恰好完全反应生成氧化铝和铁,然后将生成物与足量稀硫酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比可能是???????????????????????????????????(???)
A.3:4
B.1:l
C.5:6
D.2:3
参考答案:AC
本题解析:略
本题难度:一般