微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定要加入适当的氧化剂才能实现的转化是(??)
A.PCl3→PCl5
B.MnO4- → Mn2+
C.Na2O2→O2
D.SO3→SO42-
参考答案:A
本题解析:
试题分析: 一定要加入适当的氧化剂才能实现转化说明给定的物质中的元素的化合价升高,失去电子。A中P化合价升高。正确。B Mn化合价降低,错误。C 中氧元素的化合价升高,但是过氧化钠在与水或者二氧化碳的反应中都是既作氧化剂又作还原剂,不一定要外加氧化剂才能实现。错误。D 中元素的化合价没变。错误。
本题难度:一般
2、填空题 (10分)现有下列十种物质:①H2???②铝???③CuO???④CO2????⑤H2SO4???⑥Ba(OH)2????⑦红褐色的氢氧化铁液体???⑧氨水???⑨稀硝酸???
⑩Al2 (SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准
| ?
| 氧化物
| ?
| ?
| 电解质
|
属于该类的物质
| ②
| ?
| ⑧⑨
| ⑦
| ?
(2)写出⑥⑨的化学反应方程式???????????????????????。
(3)⑩在水中的电离方程式为?????????????????????????????,17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为?????????????,SO42-的物质的量浓度为???????????????。
(4)少量的④通入⑥的溶液中反应的化学方程式为??????????????????????。
参考答案:(10分)(1)
分类标准
金属单质
氧化
本题解析:考查物质的分类及有关化学用语的书写。
(1)铝是金属单质。由两种元 素组成的,其中一种是氧元素的化合物是氧化物,所以属于氧化物的是③④;氨水和稀硝酸都是溶液;红褐色的氢氧化铁液体属于胶体;溶于水或熔融状态下,能自身电离出阴阳离子的化合物是电解质,属于属于电解质的是③⑤⑥⑩。
(2)氢氧化钡是强碱,硝酸是强酸,二者发生中和反应,反应的化学方程式是Ba(OH)2+2HNO3=Ba(NO3)2+2H2O。
(3)硫酸铝是电解质,完全电离,所以电离方程式是Al2(SO4)3= 2Al3++3SO4
本题难度:一般
3、选择题 下列化学用语使用正确的是(? )
A.葡萄糖、淀粉的最简式都是CH2O
B.CH4的电子式是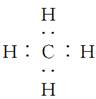
C.乙醛分子的结构简式是CH3COH
D.丙烷分子的球棍模型是
参考答案:B
本题解析:A项,淀粉的最简式为C6H10O5;C项,乙醛的结构简式为CH3CHO;D项,所给球棍模型可表示丙烯。
本题难度:一般
4、填空题 雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
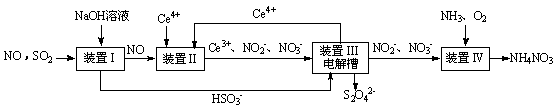
(1)装置Ⅰ中的主要离子方程式为?????????????????????????????????????????。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
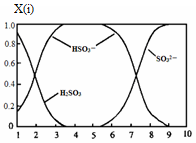
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是????????????????????????????????????。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:????????????????????????????????????。
(3)写出装置Ⅱ中,酸性条件下的离子方程式??????????????????????????????????????。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
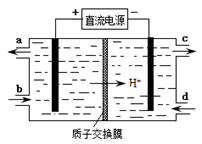
①生成Ce4+从电解槽的????????(填字母序号)口流出。
②写出与阴极的反应式????????????????????????。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2??????????????L。(用含a代数式表示,计算结果保留整数)
参考答案:(每空2分)
(1)SO2 + OH-="==" HS
本题解析:
试题分析:(1)装置Ⅰ中的将SO2变成了HSO3-,离子方程式是SO2 + OH-="==" HSO3-。
(2)①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,图像中的c(SO32-)>c(HSO3-),而c(OH-)=10-6mol/L,远小于c(OH-),故溶液中离子浓度为:c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)。②HSO3- 在溶液中存在电离平衡:HSO3- 本题难度:困难 本题难度:困难
5、选择题 将9.60×10-4 mol 的XO4-在溶液中还原到较低价态,需用24 mL 0.100 mol/L 的H2O2溶液,则X元素的化合价变为
A.+1
B.+2
C.+3
D.+4
参考答案:B
本题解析:
试题分析:反应中H2O2变成O2,O元素的化合价由-1价升高为0价,1mol双氧水失去2mol电子。反应前X元素的化合价是+7价,设元素X在还原产物中的化合价为n,则由电子得失守恒可知9.60×10-4mol×(7-n)=0.024L×0.100mol/L×2×(1-0),解得n=2,答案选B。
考点:考查氧化还原反应的计算
本题难度:一般
|