微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)将4 mol SO2和2 mol O2气体在2L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g)若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:
2SO3 (g)若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:
小题1:v(O2);
小题2:SO2的转化率;
小题3:2s时的O2浓度。
参考答案:
小题1:0.15mol/(L·s);
小题1:
本题解析:考查可逆反应的应该计算。在可逆反应的计算中往往采用三段式,即分别列出起始量、转化量、平衡(或某时刻)量,然后根据条件列式计算即可。
反应式为?????????????? 2SO2(g)+O2 (g) 2SO3 (g)
2SO3 (g)
起始量(mol)?????????? 4?????? 2?????????? 0
转化量(mol)?????????? 1.2???? 0.6???????? 1.2
2s后(mol)??????????? 2.8???? 1.4????????? 1.2
(1)用氧气表示的反应速率为
(2)SO2的转化率为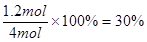
(3)2s时的O2浓度为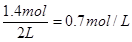
本题难度:一般
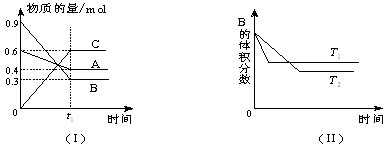
2、选择题 T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C物质的量变化如图(Ⅰ)所示;若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在(t1+1)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+1)min时,保持容器压强不变,通入稀有气体,平衡向正反应方向移动
C.不再增减物质,只改变压强或温度时,A的体积分数V(A)%变化范围为25%<V(A)%<40%
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
参考答案:C
本题解析:由(I)图三物质的物质的量的变化值得可求得该可逆反应的化学方程式为:A+3B 3C;
3C;
可看出,加压,平衡正向移动,排除A;保持容器压强不变,通入稀有气体,相当于减压,平衡左移,排除B;
由(II)图可知,T1温度下先达到平衡,即T1>T2,并且温度越高,B的体积分数越大,说明升温平衡左移,A的转化率降低,排除D
在t1时刻反应达到平衡、采用极值法平衡向两方移动时各物质的量分别为:
化学反应:??? A??? +?? 3B ? 3C
? 3C
t1时刻:????? 0.4??????? 0.3????? 0.6
完全正向移动:0.3??????? 0?????? 0.9????此时A的体积分数V(A)%=25%
完全逆向移动:0.6??????? 0.9?????? 0????此时A的体积分数V(A)%=40%
故答案为C
本题难度:一般
3、选择题 下列可逆反应中,正反应是吸热反应的是
A.PCl3(l)+Cl2(g) PCl5(s) 降温,PCl3转化率增大
PCl5(s) 降温,PCl3转化率增大
B.NO2(g)+SO2(g) NO(g)+SO3(g) 降温,SO3的体积分数增加
NO(g)+SO3(g) 降温,SO3的体积分数增加
C.2NO2 (g) 2NO(g)+O2(g) 降温,颜色加深
2NO(g)+O2(g) 降温,颜色加深
D.CS2(l)+2H2O(g) CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大
CO2(g)+2H2S(g) 升温,CO2的平衡浓度增大
参考答案:CD
本题解析:A、降温,PCl3转化率增大,平衡正向移动,正反应放热;
B、降温,SO3的体积分数增加,平衡正向移动,正反应放热;
C、降温,颜色加深,平衡逆向移动,逆向放热,正向吸热;
D、升温,CO2的平衡浓度增大,平衡正向移动,正向吸热。
本题难度:一般
4、选择题 密闭容器中发生反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始量分别为0.10 mol、0.3 mol、 0.2 mol,一定条件下达到平衡时,各组分的物质的量有可能是(???)
2Z(g),已知X2、Y2、Z的起始量分别为0.10 mol、0.3 mol、 0.2 mol,一定条件下达到平衡时,各组分的物质的量有可能是(???)
A.Z为0.3 mol
B.Y2为0.35 mol
C.X2为0.2 mol
D.Z为0.4 mol
参考答案:AB
本题解析:因为可逆反应不可能向某个方向进行到底,所以选A、B。
本题难度:一般
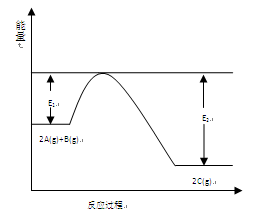
5、填空题 (9分)一定条件下,在一容积可变的密闭容器中,反应: 过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
时间(min)
| 0
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
|
n(A)
| 2.00
| 1.90
| 1.82
| 1.76
| 1.64
| 1.54
| 1.50
| 1.50
| 1.50
|
n(B)
| 1.00
| 0.95
| 0.91
| 0.88
| 0.82
| 0.77
| 0.75
| 0.75
| 0.75
|
n(C)
| 0
| 0.10
| 0.18
| 0.24
| 0.36
| 0.46
| 0.50
| 0.50
| 0.50
|
回答下列问题:
(1)反应 的正反应△H????(填“大于”或“小于”)0。
的正反应△H????(填“大于”或“小于”)0。
(2)该反应平衡时,下列说法不正确的是??????????
(A)气体的密度不再改变?????????(B)A的物质的量浓度不变
(C)放出或吸收的热量不再变化???(D)v正(A)=v逆(A)=0
(3)toC时,在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,在一定条件下发生反应,反应中C的物质的量浓度变化情况如下图:
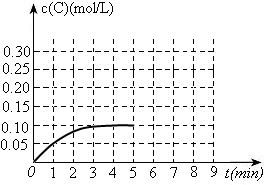
①该温度下,反应: 的平衡常数K=????????????????。
的平衡常数K=????????????????。
②反应进行到1分钟时B物质的量为????????????。
③在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在上图中画出第5min到新平衡时C的物质的量浓度的变化曲线。
参考答案:(共9分)
(1)<?(2)D (3)①? 4?②0.
本题解析:(1)产物总能量小于反应物总能量,故正反应是放热反应,△H<0
(2)化学平衡是一动态平衡,v正(A)=v逆(A)≠0
(3)①由图可知,平衡时c(C)=0.1mol/L,由方程式可求出c(A)、c(B)分别为0.1mol/L、0.25mol/L,进而可求出K=4
②由图可知,反应进行到1分钟时c(C)=0.05mol/L,即0.1mol,可求出B消耗了0.05mol;还剩余0.55mol
③在第5min时,将容器的体积缩小一半,c(C)瞬间增大一倍,即0.2mol/L;在第8min达到新的平衡时A的总转化率为75%,则可求出生成C为0.3mol,c(C)=0.3mol/L。
本题难度:一般