?Na2S2O8
(2)已知NaHSO3溶液显弱酸陛,请写出该溶液中存在的各种平衡反应的离子方程式:????????????????????。
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子:????????????????????????????。
Na2SO3溶液放置于空气中一段时间后,溶液的pH??????(填“增大”“减小”或“不变”)。(不考虑水的蒸发)原因是?????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????????????????。
(4)某同学设计如下实验流程探究Na2S2O3的化学性质。
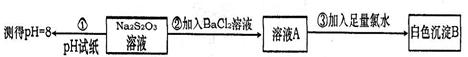
实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有???????性。请你预测Na2S2O3还可能具有的化学性质(列举2条即可)????????????????????????、??????????????????????????????????。
参考答案:(1)(2分)
化合价
-2
-1
本题解析:
试题分析:(1)硫元素表现-2价,有硫化钠等,硫元素表现+4价,有二氧化硫、亚硫酸盐等,故答案为:Na2S等;SO2等;
(2)溶液中存在水的电离平衡、亚硫酸氢根的电离平衡与水解平衡,平衡反应的离子方程式分别为HSO3-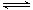 H++SO32-、HSO3-+H2O H++SO32-、HSO3-+H2O 本题难度:困难 本题难度:困难
2、选择题 采用循环操作可提高原料的利用率,在下列工业生产中,没有采用循环操作的是?????(???)
A.硫酸
B.合成氨
C.硝酸
D.氯碱
参考答案:D
本题解析:略
本题难度:简单
3、选择题 臭氧(O3)可使湿润的KI淀粉试纸变蓝,反应为KI+O3+H2O KOH+I2+O2(未配平),由此可得出下列结论正确的是( )? KOH+I2+O2(未配平),由此可得出下列结论正确的是( )?
A.O3在反应中被氧化为O2?
B.O3的氧化能力大于O2?
C.1 mol O3在反应中得到2 mol电子?
D.反应中氧化产物O2与还原产物I2的物质的量之比为1∶1
参考答案:C
本题解析:反应配平后:2KI+O3+H2O====2KOH+I2+O2
还原剂为I-,氧化剂为O3中的1个氧原子。
A中说O3在反应中被氧化,是错误的。
B中O3比O2的氧化能力大的说法是正确的,如Ag、Hg在空气或氧气中不易被氧化的金属,可以与臭氧发生反应。但在本题中由于O2的化合价没有改变,它既不是氧化产物也不是还原产物,故得出O3的氧化能力大于O2是不正确的。C项正确。D项不正确,O2不是氧化产物。
本题难度:简单
4、实验题 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是??????????,A中发生反应的化学方程式为??????????????????;
(2)实验过程中,装置B、C中发生的现象分别是?????????????、?????????????,这些现象分别说明SO2具有的性质是?????????和?????????;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象???????????;
(4)尾气可采用????????????溶液吸收。
参考答案:(共10分)(1)分液漏斗(1分)? Na2SO3+H2SO
本题解析:
试题分析:(1)装置A中盛放浓硫酸的仪器为分液漏斗,故答案为:分液漏斗;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,故答案为:红色逐渐变浅直至完全褪去;
(3)二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊,B中S元素的化合价升高,表现还原性,C中二氧化硫中硫元素的
化合价降低,表现氧化性,故答案为:2S2-+SO2+2H2O=3S↓+4OH-
本题难度:一般
5、填空题 (12分)【化学—化学与技术】
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为???????????,该反应在????????中进行(填设备名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的?????????????????(填设备名称)中进行反应。在如图所示的装置中,C处流出的气体有????????????;SO3进入???????????(填设备名称)用____????吸收,得到浓硫酸或发烟硫酸。

(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是??????????????????。
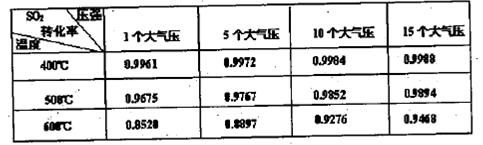
(4)吸收塔排出的尾气中SO2的含量如果超过500 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式????? L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式?????
????????????????????????????。
参考答案:(12分)
(1)4FeS2+11O2 ![]()
本题解析:
试题分析:(1)黄铁矿的主要成分为4FeS2,煅烧时与O2反应生成Fe2O3和SO2,化学方程式为:4FeS2+11O2  2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉。 2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉。
(2)SO2转化为SO3在接触室中进行;SO2与O2的反应为可逆反应,所以C处流出的气体有:SO2、SO3、O2;为了防止酸
本题难度:一般
|